Lấy cùng một lượng KClO3 và KMnO4 để điều chế oxi. Chất nào tạo ra nhiều khí O2 hơn.
a) Viết phương trình phản ứng và giải thích.
b) Nếu điều chế dùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết rằng giá KMnO4 là 30.000 đ/kg và KClO3 là 96.000 đ/kg.

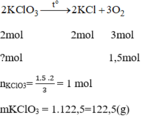
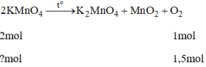
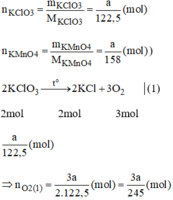
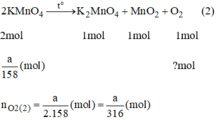
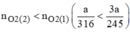 nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là
nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là 

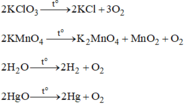
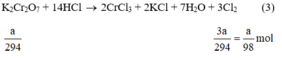
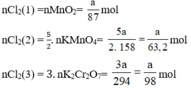
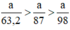
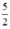 . n
. n
Ta có : PT1 : 2KClO3 ----> 2KCl + 3O2
PT2 : 2KMnO4 ----> K2MnO4 + MnO2 + O2
Gọi khối lượng của KClO3 và KMnO4 là x
*PT1 : \(n_{KClO_3}=\frac{x}{M}=\frac{x}{122,5}\)
\(n_{O_2}=\frac{3}{2}n_{KClO_3}=\frac{3}{2}.\frac{x}{122,5}=\frac{3x}{245}\)
*PT2 \(n_{KMnO_4}=\frac{x}{M}=\frac{x}{158}\)
Nhận thấy \(\frac{3x}{245}>\frac{x}{158}\)=> Dùng KClO3 cho nhiều O2 hơn
Đến đoạn tình xong n KMnO4 thêm cho mình
nO = \(\frac{1}{2}n_{KMnO_4}=\frac{1}{2}.\frac{x}{158}=\frac{x}{316}\)(mol)
Rồi so sánh \(\frac{x}{316}< \frac{3x}{245}\)
Sau đó kết luận