Nếu lấy cùng một lượng (số mol) KClO3 và KMnO4 để điều chế khí oxygen thì chất nào sẽ cho nhiều khí oxygen hơn?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử cần điều chế 3,36lit O 2 tương đương với 0,15 mol O 2
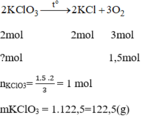
Số tiền mua 122,5g để điều chế 1,5mol O 2 :
0,1225.96000 = 11760 (đồng)
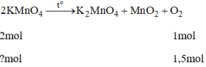
n K M n O 4 = 1,5 . 2 =3 mol
n K M n O 4 = 3.158 = 474 (g)
Số tiền mua 474g để điều chế 1,5 mol O 2 :
0,474.30000 = 14220(đồng)
Vậy để điều chế cùng 1 thể tích khí O 2 thì dùng K C l O 3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg K C l O 3 cao hơn nhưng thể tích khí O 2 sinh ra nhiều hơn.

a)6KMnO4--->3K2MnO4 + 3MnO2 + 3O2 (1)
2KClO3---> 2KCl + 3O2 (2)
Dựa vào phương trình trên ---> thu cùng lượng O2, KMnO4 cần nhiều số mol hơn, và khối lượng nhiều hơn.
b)6KClO3-->6KCl + 9O2 (3)
1,3--->Cùng số mol, KClO3 cho nhiều O2 hơn.
c)Giả sử cả 2 chất cùng có khối lượng là 100g
nKMnO4=50/79(mol)
nKClO3=40/49
Thay vào các phương trình phản ứng tính ra mO2
Cụ thể: KMnO4 cho ra 800/79 (g) O2
KClO3 cho ra 1920/49 (g) O2
---> Cùng m thì KClO3 cho nhiều g O2 hơn.
d) Giả sử cần điều chế 32 g O2
--->nO2=1 mol
--->nKMnO4=2 mol--->mKMnO4=316g
và nKClO3=2/3 mol--->nKClO3=245/3g
Ta có:
-1000g KMnO4 <=> 200000đ
316 g=========>63200đ
-1000g KClO3 <=> 300000đ
245/3g========> 24500đ
Vậy để điều chế cùng lượng O2, KClO3 có giá thành rẻ hơn.

\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(\dfrac{a}{158}.............................\dfrac{a}{79}\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(\dfrac{a}{122.5}............\dfrac{3a}{245}\)
\(TC:\)
\(\dfrac{a}{79}>\dfrac{3a}{245}\)
=> Lượng Cl2 điều chế từ KMnO4 lớn nhất.

Giả sử ta lấy cùng một khối lượng là a g
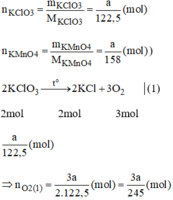
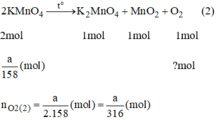
Vậy 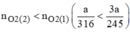 nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là
K
C
l
O
3
nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là
K
C
l
O
3

\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
\(\dfrac{m}{122,5}\) \(\dfrac{3m}{245}\) ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
\(\dfrac{m}{158}\) \(\dfrac{m}{316}\) ( mol )
So sánh:
\(\dfrac{3m}{245}\) > \(\dfrac{m}{316}\)
=> \(KClO_3\) cho nhiều O2 hơn

\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,3<------------------------------0,15
2KClO3 --to--> 2KCl + 3O2
0,1<-----------------0,15
=> \(\left\{{}\begin{matrix}m_{KMnO_4}=0,3.158=47,4\left(g\right)\\m_{KClO_3}=0,1.122,5=12,25\left(g\right)\end{matrix}\right.\)
=> Dùng KClO3 sẽ cần khối lượng nhỏ hơn

a) Giả sử lấy lượng mỗi chất là a gam
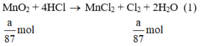
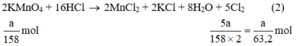
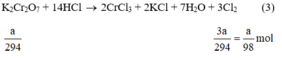
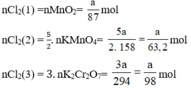
Ta có: 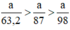
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 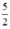 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.

KClO3 -to-> KCl + 3/2 O2
x/122,5________x________(1,5. x/122,5) (mol)
KMnO4 -to-> K2MnO4 + MnO2 + 1/2 O2
x/158_______________________(0,5. x/158) (mol)
Vì: (1,5. x/122,5=3/245x > 0,5. x/158= 1/316x )
=> KClO3 cho ra nhiều O2 hơn.

Giả sử ta lấy cùng một khối lượng là a gam
\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{a}{122,5}\left(mol\right)\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{a}{158}\left(mol\right)\)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\) (1)
Theo phương trình:
\(n_{O_2\left(1\right)}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}.\dfrac{a}{122,5}=\dfrac{3a}{245}\)
\(2KMnO_4\xrightarrow[]{t^2}K_2MnO_4+MnO_2+O_2\) (2)
Theo phương trình:
\(n_{O_2\left(2\right)}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}.\dfrac{a}{158}=\dfrac{a}{316}\left(mol\right)\)
Ta thấy: \(\dfrac{a}{316}< \dfrac{a}{245}\)
\(\Rightarrow n_{O_2\left(2\right)}< n_{O_2\left(2\right)}\)
Vậy khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là KClO3
\(PTHH:2KClO_3\underrightarrow{to}2KCL+3O_2\uparrow\)
\(2KMnO_4\underrightarrow{to}K_2MnO_4+MnO_2+O_2\uparrow\)
Từ PTHH trên ta thấy đc rằng:
\(KClO_3\) sẽ điều chế khí oxygen nhiều hơn do phân huỷ nhiều Oxygen