Điện phân một lượng dư dung dịch KCl với điện cực trơ, màng ngăn xốp thời gian 16,1 phút dòng điện I = 5A thu được 500 ml dung dịch X. pH của dung dịch X có giá trị là
A. 12,7
B. 1
C. 13
D. 1,3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

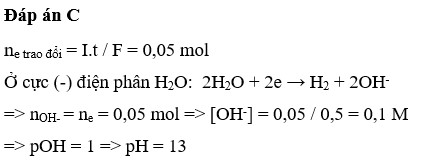

Dd có 0,5a mol CuSO4 và 0,5 mol NaCl.
Trong quá trình điện phân giả sử xảy ra :
+ Catot: Cu2+ → + 2e Cu
2H2O + 2e → 2OH- + H2
+ Anot: 2Cl- → Cl2 + 2e
ne trao đổi = 0,3 mol
=> nCl2= 0,15 mol ; nCu= 0,5a mol ; nH2= (0,3-a) mol
m giảm = m Cl2 + mCu + mH2
=> 17,15 = 71.0,15 + 64.0,5a + 2(0,3-a) => a=0,2 M
=>A

Đáp án B
ne = It/F = 5.(96,5.60)/96500 = 0,3 mol
nCl- (0,5) > ne (0,3) => Cl- chưa bị điện phân ở anot.
Giả sử Cu2+ chưa bị điện phân hết => nCu = 0,3/2 = 0,15 mol
nCl2 = 0,3/2 = 0,15 mol
m dung dịch giảm = mCu+mCl2 = 0,15.64 + 0,15.71 = 20,15 gam => Loại
=> Cu2+ bị điện phân hết, H2O đã bị điện phân ở catot.
Catot:
Cu2+ + 2e → Cu
x → 2x →x
H2O + 1e → OH- + 0,5H2
0,3-2x → 0,15-x
Anot:
Cl- - 1e → 0,5Cl2
0,3→ 0,15
m dung dịch giảm = mCu + mH2 + mCl2 => 17,15 = 64x + 2(0,15-x) + 0,15.71 => x = 0,1mol
=> a = 0,1/0,5 = 0,2 mol/lít

Chọn đáp án D
nKhí ở anot = 0,14 > 0,24/2 Þ Có tạo O2 với nO2 = 0,14 – 0,24/2 = 0,02
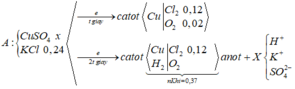
Tại t giây có ne = 0,12 x 2 + 0,02 x 4 = 0,32 Þ Tại 2t giây có ne = 0,32 x 2 = 0,64
Þ nO2 tại 2t giây = (0,64 - 0,12 x 2)/4 = 0,1 Þ nH2 = 0,37 - 0,12 - 0,1 = 0,15
Þ nCu tại 2t giây = 0,64/2 - 0,15 = 0,17 Þ x = 0,17 Þ nSO42- trong X = 0,17
BTNT.K Þ nK+ = 0,24; BTĐT trong X Þ nH+ = 0,17 x 2 - 0,24 = 0,1 Þ [H+] = 0,1M Þ pH = y = 1

Đáp án D
Thời gian điện phân t:
n k h í = 3 , 136 22 , 4 = 0,14 mol
Anot:
Cl- → Cl2 +2e
0,24 0,12 0,24 mol
H2O → H+ + O2 + 4e
0,02 0,08 mol
ne trao đổi = 0,32 mol
ne trao đổi = I t F
=> thời gian 2t, ne trao đổi = 0,64 mol
thời gian điện phân 2t nkhí = 0,37 mol
khi đó anot :
Cl- → Cl2 + 2e
0,24 0,12 0,24 mol
H2O → H+ + O2 + 4e
0,1 0,4 mol
=> n H 2 = 0,37- 0,12 – 0,1 = 0,15 mol
catot:
Cu2+ +2e → Cu
x 2x x mol
H2O + 2e → 2OH- + H2
0,15 0,3 0,3 0,15 mol
2x+0,3 = 0,64
=> x = 0,17 mol
mặt khác
nH+ =0,1 mol ⇒ [H+] = 0,1
⇒ pH = 1