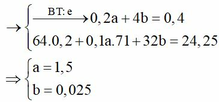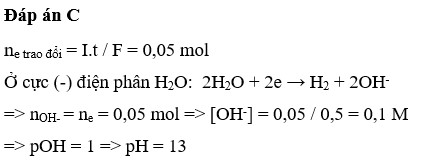
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

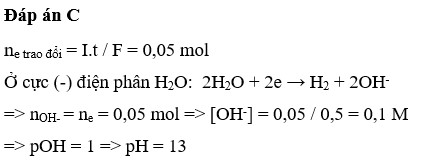

Đáp án B
ne = It/F = 5.(96,5.60)/96500 = 0,3 mol
nCl- (0,5) > ne (0,3) => Cl- chưa bị điện phân ở anot.
Giả sử Cu2+ chưa bị điện phân hết => nCu = 0,3/2 = 0,15 mol
nCl2 = 0,3/2 = 0,15 mol
m dung dịch giảm = mCu+mCl2 = 0,15.64 + 0,15.71 = 20,15 gam => Loại
=> Cu2+ bị điện phân hết, H2O đã bị điện phân ở catot.
Catot:
Cu2+ + 2e → Cu
x → 2x →x
H2O + 1e → OH- + 0,5H2
0,3-2x → 0,15-x
Anot:
Cl- - 1e → 0,5Cl2
0,3→ 0,15
m dung dịch giảm = mCu + mH2 + mCl2 => 17,15 = 64x + 2(0,15-x) + 0,15.71 => x = 0,1mol
=> a = 0,1/0,5 = 0,2 mol/lít

Đáp án C
n N a C l = 0,18 mol
Điện phân dung dịch X sau một thơi gian thấy giảm 18,65 gam
Cho Fe vào dung dịch thu được 0,035 mol NO do vậy dung dịch có H+. Do đó Cl- bị điện phân hết trước Cu2+.
Ta có:
![]()
(do Fe dư).
Lượng Fe bị ăn mòn do phản ứng này là chính bằng khối lượng thanh Fe giảm.
Do vậy Cu2+ bị điện phân hết
Ta có:
![]()
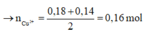
Vậy m H 2 O d p = 18,65 - 0,16.64 - 0,09.71 - 0,035.32 = 0,9 g
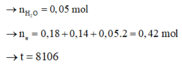

Đáp án C
Ta có n N a C l = 0 , 18 mol
Trong thời gian t giây ở anot thu được 0,15 mol khí trong đó có 0,09 mol Cl2 và còn lại là O2 0,06 mol.
→ n e = 0,09.2 + 0,06.4 = 0,42 mol
Khi thời gian điện phân là 2 t giây → n e = 0.84 mol
Vậy ở anot thu đươc 0,09 mol Cl2 và 0,165 mol O2.
Vậy ở catot thu được H2 0,17 mol.
Bảo toàn e:

= n M S O 4 . 5 H 2 O
Vậy M là Ni (59).
Tại thời gian t giây ta thu được ở catot là 0,21 mol Ni => m = 12,39 gam

Chọn A.
Ta có: ne = 0,4 mol. Tại thời điểm này tại catot có Cu (0,2 mol) và anot Cl2 (0,1a mol); O2 (b mol)