BÀI 1:Cho 2,16g bột nhôm vào 200ml dung dịch H2SO4 1M
a) Kim loại hay axit còn dư ( khi phản ứng kết thúc)
b) Tính thể tích khí thu được ( ĐKTC)
c) Tính nồng độ mol của dung dịch sau phản ứng ( cho rằng thể tích dung dịch sau phản ứng vẫn là 200 ml)
BÀI 2: Cho 2,16g bột nhôm vào dung dịch chứa 19,6g axit H2SO4 10%
a)Tính thể tích khí thu được ( ĐKTC)
b) Tính nồng độ % của các chất tan trong dung dịch thu được sau phản ứng
HỘ MÌNH VỚI Ạ, CẦN GẤP

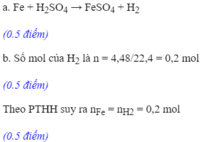

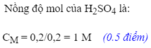
BÀI 1:Cho 2,16g bột nhôm vào 200ml dung dịch H2SO4 1M
a) Kim loại hay axit còn dư ( khi phản ứng kết thúc)
b) Tính thể tích khí thu được ( ĐKTC)
c) Tính nồng độ mol của dung dịch sau phản ứng ( cho rằng thể tích dung dịch sau phản ứng vẫn là 200 ml)
---
BÀI 2: Cho 2,16g bột nhôm vào dung dịch chứa 19,6g axit H2SO4 10%
a)Tính thể tích khí thu được ( ĐKTC)
b) Tính nồng độ % của các chất tan trong dung dịch thu được sau phản ứng
--
a) nAl= 0,08(mol)
mH2SO4=19,6.10%= 1,96(g)
=> nH2SO4= 0,02(mol)
PTHH: 2 Al +3 H2SO4 -> Al2(SO4)3 + 3 H2
Ta có: 0,08/2 > 0,02/3
=> H2SO4 hết, Al dư, tính theo nH2SO4
=> nH2= nH2SO4= 0,02(mol)
=>V(khí)=V(H2,đktc)= 0,02.22,4= 4,48(l)
b) Dung dịch sau p.ứ là dd Al2(SO4)3
nAl2(SO4)3= 1/3 . nH2SO4= 1/3 . 0,02=1/150(mol)
=> mAl2(SO4)3= 342. 1/150=2,28(g)
mddAl2(SO4)3= mAl + mddH2SO4 - mH2= 2,16 + 19,6 - 0,02.2= 21,72(g)
\(\rightarrow C\%ddAl_2\left(SO_4\right)_4=\frac{2,28}{21,72}.100\approx10,497\%\)