6g{Mg/Fe + HCl 1M -> 3,36 lít H2 đktc
a)mMg, mFe
b)%mMg,%mFe
c)Vdd HCl
d)CM từng chất sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH :
$n_{Fe\ pư} = n_{H_2} = \dfrac{33,6}{22,4} = 1,5(mol)$
$m_{Fe\ pư} = 1,5.56 = 84(gam)$
b)
$n_{HCl} = 2n_{H_2} = 3(mol) \Rightarrow C_{M_{HCl}} = \dfrac{3}{0,5} = 6M$

Cho sơ đồ phản ứng sau: Fe + HCl ---> FeCl2 + H2↑
Biết khối lượng Fe 14kg, FeCl2 12kg, H2 8kg.
1.Định luật bảo toàn khối lượng?
A. mFe + mHCl ---> mFeCl2 + mH2
B. mFe + mHCl → mFeCl2 + mH2
C. mHCl = ( mFeCl2 + mH2 ) - mFe
D. mFe + mHCl = mFeCl2 + mH2
2.Tính khối lượng HCl tác dụng?
A. 34kg B. 34g C. 6Kg D. 6g

Gọi: \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\\n_{Zn}=d\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
BT e, có: 2nFe + 2nMg + 3nAl + 2nZn = 2nH2
⇒ 2a + 2b + 3c + 2d = 0,2 (1)
Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
BT e, có: 3nFe + 2nMg + 3nAl + 2nZn = 2nSO2
⇒ 3a + 2b + 3c + 2d = 0,3 (2)
Trừ 2 vế của (2) và (1), được: a = 0,1 (mol)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1.56}{32}.100\%=17,5\%\)

\(n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo đề HCl dư nên tính theo H2
Mg + 2HCl \(\rightarrow\) MgCl2 + H2
de: 0,2 0,05
pu: 0,05 0,1 0,05 0,05
spu: 0,05 0,1 0,05 0
a, \(m_{Mg}=0,05.24=1,2g\)
b, \(m_{HCl\left(dư\right)}=0,1.36,5=3,65g\)
Cho Mg + 100g dung dịch HCl → 6,72 (khí H2 đktc)
a) Tính mMg phản ứng
b) Tính nồng độ % dung dịch Axit

a) \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Mg + 2HCl ---> MgCl2 + H2
0,3<---0,6<----------------0,3
=> \(m_{Mg}=0,3.24=7,2\left(g\right)\)
b) \(C\%_{HCl}=\dfrac{0,6.36,5}{100}.100\%=21,9\%\)

Đáp án B.
Số mol H2 là:
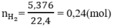
Số mol HCl nHCl = 0,5.1 = 0,5(mol)
2M + 2nHCl → 2MCln + nH2
Số mol HCl phản ứng: nHCl = 2. nH2 = 2.0,24 = 0,48(mol). So với ban đầu HCl phản ứng còn dư
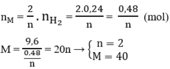
Vậy M là Ca

a,\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right);n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,15 0,3
Ta có: \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\) ⇒ H2 pứ hết,Fe dư
\(V_{H_2}=3,36\left(l\right)\) (đề cho)
b, ko tính đc k/lg dd ,chỉ tính đc thể tích dd
\(V_{ddHCl}=\dfrac{0,2}{1}=0,2\left(l\right)=200\left(ml\right)\)

- Chất rắn không tan là Cu.
Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 56y = 17,4 - 6,4 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y=\dfrac{9,916}{24,79}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
Mg + 2HCl → MgCl2 + H2↑ (1)
Fe + 2HCl → FeCl2 + H2↑ (2)
\(n_{H_2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
a) Gọi x,y lần lượt số mol của Mg và Fe
Ta có: \(24x+56y=6\) (*)
Theo Pt1: \(n_{H_2}=n_{Mg}=x\left(mol\right)\)
Theo PT2: \(n_{H_2}=n_{Fe}=y\left(mol\right)\)
Ta có: \(x+y=0,15\) (**)
Từ (*)(**) ta có: \(\left\{{}\begin{matrix}24x+56y=6\\x+y=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,075\\y=0,075\end{matrix}\right.\)
Vậy \(n_{Mg}=0,075\left(mol\right)\Rightarrow m_{Mg}=0,075\times24=1,8\left(g\right)\)
\(n_{Fe}=0,075\left(mol\right)\Rightarrow m_{Fe}=0,075\times56=4,2\left(g\right)\)
b) \(\%m_{Mg}=\frac{1,8}{6}\times100\%=30\%\)
\(\%m_{Fe}=100\%-30\%=70\%\)
c) Theo pT1: \(n_{HCl}=2n_{Mg}=2\times0,075=0,15\left(mol\right)\)
Theo PT2: \(n_{HCl}=2n_{Fe}=2\times0,075=0,15\left(mol\right)\)
\(\Rightarrow\Sigma n_{HCl}=0,15+0,15=0,3\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\frac{0,3}{1}=0,3\left(l\right)=300\left(ml\right)\)
d) Theo pT1: \(n_{MgCl_2}=n_{Mg}=0,075\left(mol\right)\)
\(\Rightarrow C_{M_{MgCl_2}}=\frac{0,075}{0,3}=0,25\left(M\right)\)
Theo PT2: \(n_{FeCl_2}=n_{Fe}=0,075\left(mol\right)\)
\(\Rightarrow C_{M_{FeCl_2}}=\frac{0,075}{0,3}=0,25\left(M\right)\)
Đặt :
nFe = x mol
nMg= y mol
mhh= 56x + 24y = 6 (g) (1)
nH2 = 3.36/22.4=0.15 mol
Fe + 2HCl --> FeCl2 + H2
x_____2x______x_____x
Mg + 2HCl --> MgCl2 + H2
y_____2y_______y_____y
nH2 = x + y = 0.15 (2)
Giải (1) và (2) :
x = y = 0.075
mFe = 4.2g
mMg = 1.8 g
%Fe = 70%
%Mg = 30%
Từ PTHH ta thấy :
nHCl = 2nH2 = 0.3 mol
VddHCl = 0.3/1=0.3 l
CM FeCl2 = CM MgCl2 = 0.075/0.3 = 0.25M