Lấy một lượng KCLO3 và KMnO4 để điều chế khí O2.Chất nào cho nhiều khí O2 hơn?
a>Viết phương trình hóa học và giải thích?
b>Nếu ddieuf chế cùng một thể tích khí oxi thì dùng chât nào kinh tế hơn?Biết giá KMnO4 là 45000đ và giá của KCLO3 là 11100đ? HEPL ME !!!!!!!!!!!!!!!!!!

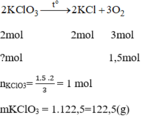
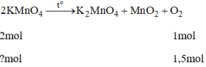
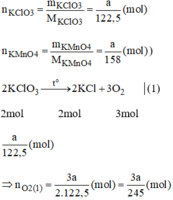
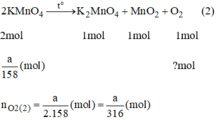
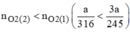 nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là
nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là 

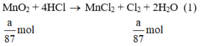
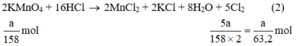
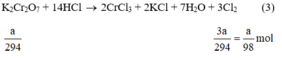
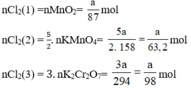
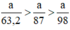
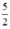 . n
. n
\( {M_{KCl{O_3}}} = 122,5(g/mol);{M_{KMn{O_4}}} = 158(g/mol)\)
Giả sử ta lấy cùng một khối lượng là a gam
\(2KCl{O_3}\buildrel {{t^o}} \over\longrightarrow 2KCl + 3{O_2} \uparrow \)
2 mol..............................3 mol
\({a \over {122,5}}mol ............. {{3a} \over {2 \times 122,5}}mol\)
\(2KMn{O_4}\buildrel {{t^o}} \over\longrightarrow {K_2}Mn{O_4} + {O_2} \uparrow + Mn{O_2}\)
2 mol......................................1 mol
\({a \over {158}}mol...................{a \over {2 \times 158}}mol\)
\({{3a} \over {2 \times 122,5}}mol > {a \over {2 \times 158}}mol\)
Khi nhiệt phân cùng một lượng, chất cho nhiều \({O_2}\)hơn là \(KCl{O_3}\)
b) Nếu điều chế cùng một thể tích khí O2 thì dùng KClO3 để điều chế kinh tế hơn, tuy giá tiền 1 kg cao hơn nhưng thể tích khí O2 sinh ra nhiều hơn. Tính toán cụ thể như sau :
\(2KCl{O_3}\buildrel {{t^o}} \over\longrightarrow 2KCl + 3{O_2} \uparrow \)
2 mol...............................3 mol
1 mol...............................1,5 mol
\({m_{KCl{O_2}}} = 1 \times 122,5 = 122,5(g)\)
Số tiền mua 122,5 g để điều chế 1,5 mol \({O_2}\) là
0,1225 .11100=1359,75 đ
\(2KMn{O_4}\buildrel {{t^o}} \over\longrightarrow {K_2}Mn{O_4} + {O_2} \uparrow + Mn{O_2}\)
2 mol......................................1 mol
3 mol............................................1,5 mol
\({m_{KMn{O_4}}} = 3 \times 158 = 474(g)\)
Số tiền mua 474 g \(KMn{O_4}\) để điều chế 1,5 mol \({O_2}\) là:
0,474*45000=21330đ
\(2KMn{O_4}\buildrel {{t^o}} \over\longrightarrow {K_2}Mn{O_4} + {O_2} \uparrow + Mn{O_2}\)
2 mol......................................1 mol
tại sao 3a/2.122,5