Hòa tan 4,6g Na vào 200ml nước. Tính nồng độ mol dung dịch thu được. (Sự hòa tan không làm thay đổi thể tích dung dịch)
GIÚP MK GIẢI NAH! THANKS!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(2Na+2H_2O\rightarrow2NaOH+H_2\)
b, \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Theo PT: \(n_{NaOH}=n_{Na}=0,2\left(mol\right)\Rightarrow m_{NaOH}=0,2.40=8\left(g\right)\)
c, \(C_{M_{NaOH}}=\dfrac{0,2}{0,2}=1\left(M\right)\)

a) \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\); nHCl = 0,2.2,5 = 0,5 (mol)
PTHH: Mg + 2HCl --> MgCl2 + H2
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\) => Mg hết, HCl dư
PTHH: Mg + 2HCl --> MgCl2 + H2
0,2--->0,4----->0,2---->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b) \(\left\{{}\begin{matrix}C_{M\left(HCl.dư\right)}=\dfrac{0,5-0,4}{0,2}=0,5M\\C_{M\left(MgCl_2\right)}=\dfrac{0,2}{0,2}=1M\end{matrix}\right.\)
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
200ml = 0,2l
\(n_{HCl}=2,5.0,2=0,5\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,2 0,5 0,2 0,2
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)
⇒ Mg phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Mg
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
b) \(n_{MgCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(n_{HCl\left(dư\right)}=0,5-\left(0,2.2\right)=0,1\left(mol\right)\)
\(C_{MMgCl2}=\dfrac{0,2}{0,2}=1\left(M\right)\)
\(C_{MddHCl\left(dư\right)}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Chúc bạn học tốt

a) \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
PTHH: 4Na + O2 --to--> 2Na2O
______0,1->0,025----->0,05
=> VO2 = 0,025.22,4 = 0,56(l)
b)
PTHH: Na2O + H2O --> 2NaOH
______0,05----------->0,1
=> \(C_{M\left(NaOH\right)}=\dfrac{0,1}{0,2}=0,5M\)

200ml = 0,2l
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,2 0,2
\(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(C_{M_{FeCl2}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Chúc bạn học tốt

\(n_{Na}=\dfrac{2.3}{23}=0.1\left(mol\right)\)
\(n_{HCl}=0.4\cdot2=0.8\left(mol\right)\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(0.8..............0.8\)
\(2Na+2H_2O\rightarrow2NaOH+H_{_{ }2}\)
\(0.1........................0.1\)
\(n_{NaOH}=0.1< 0.8\)
Đề nhầm lãn !

Đáp án D
nNaCl =0,1 mol, nAgNO3 = 0,2 mol
NaCl + AgNO3 → AgCl + NaNO3
0,1 → 0,1 0,1 (mol)
Vdd = 300 + 200 = 500 ml
![]() (dư) = 0,2 - 0,1 =0, 1 (mol)
(dư) = 0,2 - 0,1 =0, 1 (mol)
![]() = 0,1 mol
= 0,1 mol
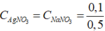 = 0,2 M
= 0,2 M

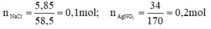
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 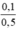 = 0,2 mol/l.
= 0,2 mol/l.

\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 0,2 0,2 0,2
a)\(V_{H_2}=0,2\cdot22,4=4,48l\)
b)\(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,5}=0,4M\)
c)\(C_{M_{FeSO_4}}=\dfrac{0,2}{0,5}=0,4M\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
pthh : \(Fe+H_2SO_4->FeSO_4+H_2\)
0,2 0,2
=> \(V_{H_2}=0,2.22,4=4,48\left(L\right)\)
\(m_{H_2SO_4}=\dfrac{0,5}{22,4}.98\approx2,188\left(g\right)\)
=> mdd=11,2+2,188=13,388(g)
C%=\(\dfrac{2,188}{13,388}.100\%=16,3\%\)
nNa = \(\dfrac{4,6}{23}=0,2\) mol
Pt: 2Na + 2H2O --> 2NaOH + H2
0,2 mol-------------> 0,2 mol
CM NaOH = \(\dfrac{0,2}{0,2}=1M\)