Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(2Na+2H_2O\rightarrow2NaOH+H_2\)
b, \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Theo PT: \(n_{NaOH}=n_{Na}=0,2\left(mol\right)\Rightarrow m_{NaOH}=0,2.40=8\left(g\right)\)
c, \(C_{M_{NaOH}}=\dfrac{0,2}{0,2}=1\left(M\right)\)

a) \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\); nHCl = 0,2.2,5 = 0,5 (mol)
PTHH: Mg + 2HCl --> MgCl2 + H2
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\) => Mg hết, HCl dư
PTHH: Mg + 2HCl --> MgCl2 + H2
0,2--->0,4----->0,2---->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b) \(\left\{{}\begin{matrix}C_{M\left(HCl.dư\right)}=\dfrac{0,5-0,4}{0,2}=0,5M\\C_{M\left(MgCl_2\right)}=\dfrac{0,2}{0,2}=1M\end{matrix}\right.\)
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
200ml = 0,2l
\(n_{HCl}=2,5.0,2=0,5\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,2 0,5 0,2 0,2
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)
⇒ Mg phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Mg
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
b) \(n_{MgCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(n_{HCl\left(dư\right)}=0,5-\left(0,2.2\right)=0,1\left(mol\right)\)
\(C_{MMgCl2}=\dfrac{0,2}{0,2}=1\left(M\right)\)
\(C_{MddHCl\left(dư\right)}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Chúc bạn học tốt

\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 0,2 0,2 0,2
a)\(V_{H_2}=0,2\cdot22,4=4,48l\)
b)\(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,5}=0,4M\)
c)\(C_{M_{FeSO_4}}=\dfrac{0,2}{0,5}=0,4M\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
pthh : \(Fe+H_2SO_4->FeSO_4+H_2\)
0,2 0,2
=> \(V_{H_2}=0,2.22,4=4,48\left(L\right)\)
\(m_{H_2SO_4}=\dfrac{0,5}{22,4}.98\approx2,188\left(g\right)\)
=> mdd=11,2+2,188=13,388(g)
C%=\(\dfrac{2,188}{13,388}.100\%=16,3\%\)

\(n_{CuSO_4}=\dfrac{10}{160}=0,0625\left(mol\right)\\ C_{MddCuSO_4}=\dfrac{0,0625}{0,2}=0,3125\left(M\right)\\ m_{ddCuSO_4}=200.1,26=252\left(g\right)\\ C\%_{ddCuSO_4}=\dfrac{10}{252}.100\%\approx3,968\%\)

Ta có: \(C\%_{NaOH}=\dfrac{8}{8+100}.100\%\approx7,41\%\)
\(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
V dd sau hòa tan = 100 (ml) = 0,1 (l)
\(\Rightarrow C_{M_{NaOH}}=\dfrac{0,2}{0,1}=2\left(M\right)\)

\(a,C_{M\left(NaOH\right)}=\dfrac{0,3}{0,5}=0,6M\\ b,n_{NaOH}=\dfrac{24}{40}=0,6\left(mol\right)\\ C_{M\left(NaOH\right)}=\dfrac{0,6}{0,4}=1,5M\)

\(n_{CaO}=\dfrac{6.72}{56}=0.12\left(mol\right)\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
\(0.12..........................0.12\)
\(m_{Ca\left(OH\right)_2}=0.12\cdot74=8.88\left(g\right)\)
\(C_{M_{Ca\left(OH\right)_2}}=\dfrac{0.12}{0.2}=0.6\left(M\right)\)
PTHH: \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Ta có: \(n_{CaO}=\dfrac{6,72}{56}=0,12\left(mol\right)=n_{Ca\left(OH\right)_2}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Ca\left(OH\right)_2}=0,12\cdot74=8,88\left(g\right)\\C_{M_{Ca\left(OH\right)_2}}=\dfrac{0,12}{0,2}=0,6\left(M\right)\end{matrix}\right.\)
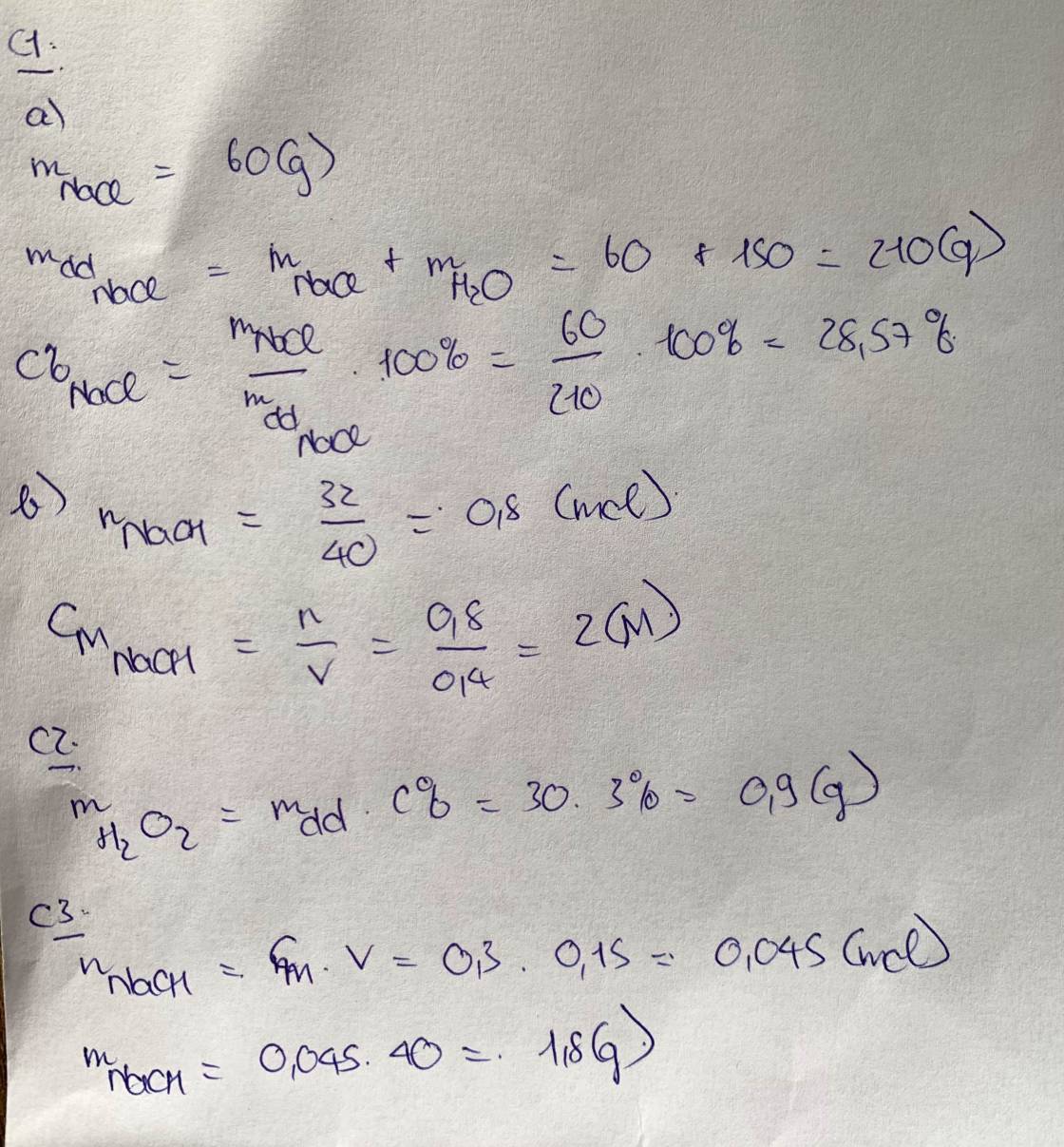
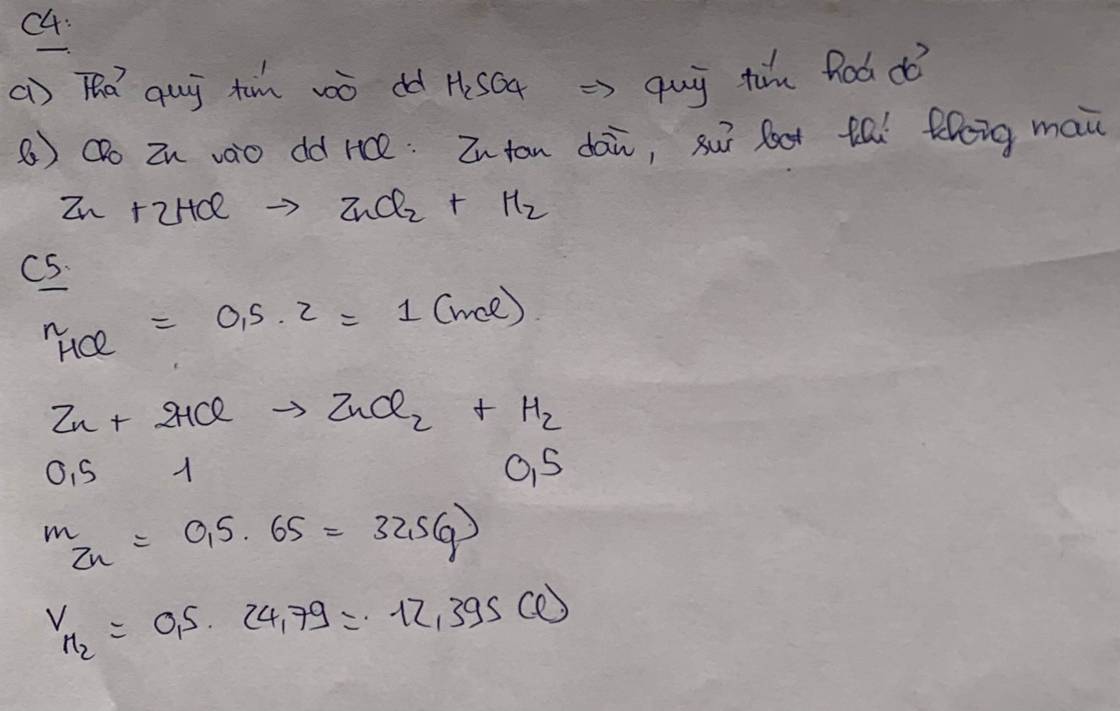
nNa = \(\dfrac{4,6}{23}=0,2\) mol
Pt: 2Na + 2H2O --> 2NaOH + H2
0,2 mol-------------> 0,2 mol
CM NaOH = \(\dfrac{0,2}{0,2}=1M\)