- - Caroten (chất hữu cơ có trong củ cà rốt, các trái cây có màu vàng …) có màu da cam. Nhờ tác dụng của enzim trong ruột non, - Caroten chuyển thành vitamin A nên nó còn được gọi là tiền vitamin A. Đốt cháy hoàn toàn 6,7 gam - Caroten bằng khí oxi dư, rồi dẫn sản phẩm cháy lần lượt qua bình (1) đựng H2SO4 đặc, sau đó qua bình (2) đựng dung dịch Ca(OH)2 dư, sản phẩm cháy bị háp thụ hết trong các dung dịch. Kết quả cho thấy khối lượng bình (1) tăng 6,3 gam; bình (2) có 50,0 gam kết tủa. Xác định công thức phân tử của - Caroten, biết - Caroten có khối lượng mol phân tử bằng 536,00 gam/mol.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Khi oxi hóa hoàn toàn b-caroten tạo ra CO2 và H2O
H2O bị hấp thụ tại bình H2SO4 đặc(1) => mH2O = m1 tăng = 0,63g => nH = 0,07 mol
CO2 bị hấp thụ tại bình Ca(OH)2 dư (2) => nCaCO3 = nCO2 = 0,05 mol
=> nC : nH = 0,05 : 0,07 = 5 : 7
Vậy CTĐG nhất của b-caroten là C5H7

Ca(OH)2 + CO2 → CaCO3 + H2O
Khối lượng bình (1) tăng là khối lượng của H2O = 0,63(g)
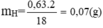
mCaCO3 = 5g ⇒ nCO2 = nCaCO3 = 5/100 = 0,05 mol
BT nguyên tố ⇒ nC = nCO2 = 0,05 mol ⇒ mC = 12. 0,05 = 0,6 g

%mO = 100% - (89,55 + 10,45)% = 0%

Sản phẩm oxi hoá qua bình (1) đựng dung dịch H2SO4 đặc làm khối lượng bình (1) tăng 0,63 g chính là lượng nước bị giữ lại => mH = 0,63180,6318 x 2 = 0,07 g.
Qua bình (2) chứa dung dịch Ca(OH)2 dư, làm cho bình xuất hiện kết tủa chính là do lượng CO2 bị giữ lại vì tham gia phản ứng sau:
Ca(OH)2 + CO2 → CaCO3 + H2O
0,05 51005100 = 0,05 mol
=> mC = 0,05 x 12 = 0,6 (g).
=> mO = 0,67 - (mC + mH) = 0
Từ đó tính được %mC = 89,55%; %mH = 10,45%.

Khối lượng bình (1) tăng 0,63g chính là khối lượng H2O.
\(\Rightarrow m_H=\frac{0,63}{18}.2=0,07g\)
Ở bình (2) : \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
\(0,05\leftarrow\frac{5}{100}=0,05\)
\(\Rightarrow m_C=0,05.12=0,6g\)
\(\Rightarrow m_O=0,67-\left(m_C+m_H\right)=0\)
\(\Rightarrow\%m_C=\frac{0,6}{0,67}.100=89,55\%\)
\(\%m_H=100\%-89,55\%=10,45\%\)

ản phẩm cháy thu được là dẫn qua bình (1) chứa H2SO4 đặc và bình (2) đựng nước vôi trong dư thì sản phẩm cháy bị hấp thụ hết
=> Sản phẩm cháy: CO2 và H2O
Khi dẫn sản phẩm cháy qua bình (1) thì H2O bị giữ lại trong bình, nên khối lượng bình tăng thêm chính bằng khối lượng nước
nH2O=6,318=0,35(mol)⇒nH=0,7(mol)⇒mH=0,7(g)
Dẫn tiếp qua bình (2) CO2 giữ lại trong bình,
CO2(0,5)+Ca(OH)2−−−>CaCO3(0,5)+H2O
nCaCO3=0,5(mol)n
⇒nCO2=0,5(mol)⇒nC=0,5(mol)⇒mC=6(g)
Ta có: mH+mC=6,7(g)(đúng bằng khối lượng của Caroten)
⇒CTDC:CxHy
x:y=0,5:0,7=5:7
⇒CTTN:[C5H7]n
⇔67n=536⇒n=8⇒
⇒CTPT:C40H56
Bạn tham khảo tại đây :Câu hỏi của Phan Dũng - Hóa học lớp 9 | Học trực tuyến
Sản phẩm cháy thu được là dẫn qua bình (1) chứa H2SO4 đặc và bình (2) đựng nước vôi trong dư thì sản phẩm cháy bị hấp thụ hết
=> Sản phẩm cháy: CO2 và H2O
Khi dẫn sản phẩm cháy qua bình (1) thì H2O bị giữ lại trong bình, nên khối lượng bình tăng thêm chính bằng khối lượng nước
\(n_{H_2O}=\dfrac{6,3}{18}=0,35\left(mol\right)\)\(\Rightarrow n_H=0,7\left(mol\right)\)\(\Rightarrow m_H=0,7\left(g\right)\)
Dẫn tiếp qua bình (2) CO2 giữ lại trong bình,
\(CO_2\left(0,5\right)+Ca\left(OH\right)_2--->CaCO_3\left(0,5\right)+H_2O\)
\(n_{CaCO_3}=0,5\left(mol\right)\)
\(\Rightarrow n_{CO_2}=0,5\left(mol\right)\)\(\Rightarrow n_C=0,5\left(mol\right)\)\(\Rightarrow m_C=6\left(g\right)\)
Ta có: \(m_H+m_C=6,7\left(g\right)\)(đúng bằng khối lượng của Caroten)
\(\Rightarrow CTDC:C_xH_y\)
\(x:y=0,5:0,7=5:7\)
\(\Rightarrow CTTN:\left[C_5H_7\right]_n\)
\(\Leftrightarrow67n=536\)\(\Rightarrow n=8\)
\(\Rightarrow CTPT:C_{40}H_{56}\)