Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng bình (1) tăng 0,63g chính là khối lượng H2O.
\(\Rightarrow m_H=\frac{0,63}{18}.2=0,07g\)
Ở bình (2) : \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
\(0,05\leftarrow\frac{5}{100}=0,05\)
\(\Rightarrow m_C=0,05.12=0,6g\)
\(\Rightarrow m_O=0,67-\left(m_C+m_H\right)=0\)
\(\Rightarrow\%m_C=\frac{0,6}{0,67}.100=89,55\%\)
\(\%m_H=100\%-89,55\%=10,45\%\)

Sản phẩm oxi hoá qua bình (1) đựng dung dịch H2SO4 đặc làm khối lượng bình (1) tăng 0,63 g chính là lượng nước bị giữ lại => mH = 0,63180,6318 x 2 = 0,07 g.
Qua bình (2) chứa dung dịch Ca(OH)2 dư, làm cho bình xuất hiện kết tủa chính là do lượng CO2 bị giữ lại vì tham gia phản ứng sau:
Ca(OH)2 + CO2 → CaCO3 + H2O
0,05 51005100 = 0,05 mol
=> mC = 0,05 x 12 = 0,6 (g).
=> mO = 0,67 - (mC + mH) = 0
Từ đó tính được %mC = 89,55%; %mH = 10,45%.

Ca(OH)2 + CO2 → CaCO3 + H2O
Khối lượng bình (1) tăng là khối lượng của H2O = 0,63(g)
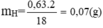
mCaCO3 = 5g ⇒ nCO2 = nCaCO3 = 5/100 = 0,05 mol
BT nguyên tố ⇒ nC = nCO2 = 0,05 mol ⇒ mC = 12. 0,05 = 0,6 g

%mO = 100% - (89,55 + 10,45)% = 0%

Đáp án B
Khi oxi hóa hoàn toàn b-caroten tạo ra CO2 và H2O
H2O bị hấp thụ tại bình H2SO4 đặc(1) => mH2O = m1 tăng = 0,63g => nH = 0,07 mol
CO2 bị hấp thụ tại bình Ca(OH)2 dư (2) => nCaCO3 = nCO2 = 0,05 mol
=> nC : nH = 0,05 : 0,07 = 5 : 7
Vậy CTĐG nhất của b-caroten là C5H7

Khối lượng bình (1) tăng 0,63g=> \(m_{H_2O}=0,63\Rightarrow n_{H_2O}=0,035\left(mol\right)\Rightarrow n_H=0,035.2=0,07\left(mol\right)\Rightarrow m_H=0,07\left(g\right)\)
\(m_{CaCO_3}=5\left(g\right)\Rightarrow n_C=n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\Rightarrow m_C=0,05.12=0,6\left(g\right)\)
\(\Rightarrow m_O=0,67-0,07-0,6=0\)
Vậy A ko chứa nguyên tố oxi
\(\Rightarrow\%H=\dfrac{0,07}{0,67}=10,45\%\Rightarrow\%C=100\%-10,45\%=89,55\%\)

Dẫn sản phẩm cháy vào bình đựng Ca(OH)2 thì CO2 và H2O bị hấp thụ
Vì đun nước lọc thu được thêm kết tủa\(\rightarrow\) Tạo ra Ca(HCO3)2
Ca(OH)2 + CO2 \(\rightarrow\)CaCO3 + H2O
Ca(OH)2 + 2CO2\(\rightarrow\) Ca(HCO3)2
Ca(HCO3)2\(\rightarrow\)CaCO3 + CO2 + H2O
nCaCO3=\(\frac{40}{100}\)=0,4 mol
nCa(HCO3)2=nCaCO3 tạo thêm=\(\frac{25}{100}\)=0,25 mol
\(\rightarrow\)nCO2=nCaCO3 +2nCa(HCO3)2=0,9 mol
m bình tăng=mCO2 + mH2O -mCaCO3 (1) =7,7 \(\rightarrow\) mCO2 + mH2O=40+7,7
\(\rightarrow\)nH2O=8,1 gam \(\rightarrow\) nH2O=0,45 mol
\(\rightarrow\) X chứa 0,9 mol C và 0,9 mol H
Vì 0,9.12 +0,9=11,7 nên không X không chứa O
\(\rightarrow\)X có dạng (CH)n
Ta có: 70 < MX <80\(\rightarrow\) n=6\(\rightarrow\) X là C6H6
nX=\(\frac{11}{78}\)=0,15 mol
Cho X tác dụng với AgNO3 /NH3 được 43,8 gam kết tủa
\(\rightarrow\)nX=n kết tủa \(\rightarrow\) M kết tủa=292
\(\rightarrow\)Số nguyên tử Ag thế vào\(\frac{\text{292-78}}{108-1}\)=2
X có 2 liên nhóm -C≡CH
CTCT của X có thể là HC≡C-CH2-CH2-C≡CH
hoặc HC≡C-CH(CH3)-C≡CH