Tính khối lượng Hiđro gồm: 4,5 x 1023 nguyên tử Oxi, 7,5 x 1023 phân tử cacbonic và 0,12 x 1023 phân tử ozon.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giải
\(m_{O2}=n.M=\frac{4,5.10^{23}}{6.10^{23}}.32=24\left(g\right)\)
\(m_{CO2}=\frac{7,5.10^{23}}{6.10^{23}}.44=55\left(g\right)\)
\(m_{O3}=\frac{0,12.10^{23}}{6.10^{23}}.48=0,96\left(g\right)\)

Khối lượng bằng gam của:
- 6,02. 10 23 phân tử nước: 6,02. 10 23 .18.1,66. 10 - 24 = 17,988(g) ≈ 18(g)
- 6,02. 10 23 phân tử C O 2 : 6,02. 10 23 .44.1,66. 10 - 24 = 43,97(g) ≈ 44(g).
- 6,02. 10 23 phân tử C a C O 3 : 6,02. 10 23 .100. 1,66. 10 - 24 = 99,9(g) ≈ 100(g).

Chọn D
A. 6. 10 23 phân tử H 2 = 1 mol H 2 ⇒ m H = 1.2 = 2g
B. 3. 10 23 phân tử H 2 O = 0,5 mol H 2 O ⇒ n H = 2. n H 2 O = 2. 0,5 = 1 mol ⇒ m H = 1.1 = 1g
C. 0,6 g C H 4 ⇒ n C H 4 = 0,6/16 = 0,0375 mol ⇒ n H = 4. n C H 4 = 0,0375 . 4 = 0,15 mol ⇒ m H = 1. 0,15 = 0,15 g
D. 1,5g N H 4 C l ⇒ n N H 4 C l = 1,5/53,5 = 0,028 mol ⇒ n H = 4. n C H 4 C l = 4. 0,028 = 0,112 mol ⇒ m H = 1. 0,112 = 0,112 g
Vậy trong N H 4 C l khối lượng hidro có ít nhất.

24.
10
23
phân tử
H
2
O
=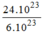 = 4(mol) phân tử
H
2
O
= 4(mol) phân tử
H
2
O
1,44.
10
23
phân tử
C
O
2
=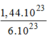 = 0,24(mol) phân tử
C
O
2
.
= 0,24(mol) phân tử
C
O
2
.
0,66.
10
23
phân tử
C
12
H
22
O
11
=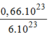 = 0,11(mol) phân tử
C
12
H
22
O
11
.
= 0,11(mol) phân tử
C
12
H
22
O
11
.

Số mol khí: n = N/ N A (N là số phân tử khí)
Mặt khác n = m/ μ . Do đó: μ = m N A /N = 15.6,02. 10 23 /5,46. 10 26 = 16,01. 10 - 3 (kg/mol) (1)
Trong các khí có hidro và cacbon thì C H 4 có:
μ = (12 + 4). 10 - 3 kg/mol (2)
So sánh (2) với (1) ta thấy phù hợp. Vậy khí đã cho là C H 4
Khối lượng của phân tử hợp chất là: m C H 4 = m/N
Khối lượng của nguyên tử hidro là:
m H 4 = 4/16 . m C H 4 = 4/16 . m/N ≈ 6,64. 10 - 27 (kg)
Khối lượng nguyên tử cacbon là:
m C = 12/16 . m C H 4 = 12/16 . m/N ≈ = 2. 10 - 26 (kg)

\(1.m_{Cu}=1,2.64=76,8\left(g\right)\\ 2.m_{NaCl}=1,25.58,5=73,125\\ 3.n_{C_6H_{12}O_6}=\dfrac{7,2.10^{23}}{6.10^{23}}=1,2\left(mol\right)\\ \Rightarrow m_{C_6H_{12}O_6}=1,2.180=216\left(g\right)\\ 4.n_{O_2}=3,6.32=115,2\left(g\right)\\ 5.n_{O_2}=\dfrac{1,2.10^{23}}{6.10^{23}}=0,2\left(mol\right)\\ \Rightarrow m_{O_2}=0,2.32=6,4\left(g\right)\\ 6.n_{N_2}=\dfrac{26,88}{22,4}=1,2\left(mol\right)\\ \Rightarrow m_{N_2}=1,2.28=33,6\left(g\right)\\ 7.n_{CO_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ \Rightarrow m_{CO_2}=0,5.44=22\left(g\right)\\ 8.n_{H_2}=\dfrac{31,36}{22,4}=1,4\left(mol\right)\\ \Rightarrow m_{H_2}=1,4.2=2,8\left(g\right)\)
\(1,m_{Cu}=1,2\cdot64=76,8\left(g\right)\\ 2,m_{NaCl}=1,25\cdot58,5=73,125\left(g\right)\\ 3,n_{C_6H_{12}O_6}=\dfrac{7,2\cdot10^{-23}}{6\cdot10^{-23}}=1,2\left(mol\right)\\ \Rightarrow m_{C_6H_{12}O_6}=1,2\cdot180=216\left(g\right)\\ 4,m_{O_2}=3,6\cdot32=115,2\left(g\right)\\ 5,n_{O_2}=\dfrac{1,2\cdot10^{-23}}{6\cdot10^{-23}}=0,2\left(mol\right)\\ \Rightarrow m_{O_2}=0,2\cdot32=6,4\left(g\right)\\ 6,n_{N_2}=\dfrac{26,88}{22,4}=1,2\left(mol\right)\\ \Rightarrow m_{N_2}=1,2\cdot28=33,6\left(g\right)\\ 7,n_{CO_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ \Rightarrow m_{CO_2}=0,5\cdot44=22\left(g\right)\\ 8,n_{H_2}=\dfrac{31,36}{22,4}=1,4\left(mol\right)\\ \Rightarrow m_{H_2}=1,4\cdot2=2,8\left(g\right)\)

a) \(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
b) \(n_{N_2}=\dfrac{1,8.10^{23}}{6.10^{23}}=0,3\left(mol\right)\)
=> \(m_{N_2}=0,3.28=8,4\left(g\right)\)
c) \(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)=>V_{CO_2}=0,2.22,4=4,48\left(l\right)\)
d) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
=> Số phân tử H2 = 0,15.6.1023 = 0,9.1023
e) \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
f) \(n_{Cl_2}=\dfrac{3,6.10^{23}}{6.10^{23}}=0,6\left(mol\right)\)
=> VCl2 = 0,6.22,4 = 13,44(l)
g) \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> mO2 = 0,3.32 = 9,6(g)
h) \(n_{K_2O}=\dfrac{18,8}{94}=0,2\left(mol\right)\)
=> Số phân tử K2O = 0,2.6.1023 = 1,2.1023
i) \(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
=> Số phân tử CaO = 0,2.6.1023 = 1,2.1023
nHCl = 0,2.1,5 = 0,3 (mol)
=> mHCl = 0,3.36,5 = 10,95(g)

\(a.n_{CO_2}=\dfrac{m_{CO_2}}{M_{CO_2}}=\dfrac{4,4}{44}=0,1\left(mol\right)\\ \Rightarrow V_{CO_2}=n_{CO_2}.22,4=0,1.22,4=2,24\left(l\right)\\ n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=0,1.22,4=2,24\left(l\right)\)
\(n_{H_2}\) = 2mol
=>\(V_{H_2}\) = 2. 22,4 = 44,8l
\(n_{O_2}\) = 0,0875 mol
=>\(V_{O_2}\) = 0,0875 . 22,4 = 1,96l
\(n_{CO_2}\) = 0,5 mol
=>\(V_{CO_2}\) = 0,5 .22,4 = \(11,2\left(l\right)\)
\(n_{O_2}\) = \(0,2\left(mol\right)\)
=>\(V_{O_2}\) = 0,2 . 22,4 = \(4,48\left(l\right)\)
b) Ta có:
\(n_{NH_3}=\dfrac{6.10^{23}}{6.10^{23}}=1\left(mol\right)\\ n_{O_2}=\dfrac{3.10^{23}}{6.10^{23}}=0,5\left(mol\right)\\ \Sigma n_{hh}=1+0,5=1,5\left(mol\right)\\ V_{hh}=1,5.22,4=33,6\left(l\right)\)
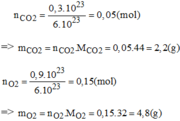
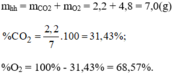
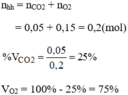
\(m_O=\dfrac{4,5.10^{23}}{6.10^{23}}.16=12\left(g\right)\\ m_{CO_2}=\dfrac{7,5.10^{23}}{6.10^{23}}.44=55\left(g\right)\\ m_{O_3}=\dfrac{0,12.10^{23}}{6.10^{23}}.48=0,96\left(g\right)\)