β - caroten ( chất hữu cơ có trong củ cà rốt ) có màu da cam . nhờ tác dụng của enzim trong ruột non , β - caroten chuyển thành vitamin A nên nó còn được gọi là tiền vitamin A . oxi hóa hoàn toàn 0,67 gam β - caroten rồi dẫn sản phẩm oxi hóa qua bình (1) đựng H2SO4 đặc , sau đó qua bình (2) đựng Ca(OH)2 dư . kết quả cho thấy khối lượng bình (1) tăng 0,63 gam ; bình (2) có 5 gam kết tủa . tính phần trăm khối lượng các nguyên tố trong phân tử β - caroten .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Khi oxi hóa hoàn toàn b-caroten tạo ra CO2 và H2O
H2O bị hấp thụ tại bình H2SO4 đặc(1) => mH2O = m1 tăng = 0,63g => nH = 0,07 mol
CO2 bị hấp thụ tại bình Ca(OH)2 dư (2) => nCaCO3 = nCO2 = 0,05 mol
=> nC : nH = 0,05 : 0,07 = 5 : 7
Vậy CTĐG nhất của b-caroten là C5H7

Ca(OH)2 + CO2 → CaCO3 + H2O
Khối lượng bình (1) tăng là khối lượng của H2O = 0,63(g)
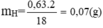
mCaCO3 = 5g ⇒ nCO2 = nCaCO3 = 5/100 = 0,05 mol
BT nguyên tố ⇒ nC = nCO2 = 0,05 mol ⇒ mC = 12. 0,05 = 0,6 g

%mO = 100% - (89,55 + 10,45)% = 0%

Sản phẩm oxi hoá qua bình (1) đựng dung dịch H2SO4 đặc làm khối lượng bình (1) tăng 0,63 g chính là lượng nước bị giữ lại => mH = 0,63180,6318 x 2 = 0,07 g.
Qua bình (2) chứa dung dịch Ca(OH)2 dư, làm cho bình xuất hiện kết tủa chính là do lượng CO2 bị giữ lại vì tham gia phản ứng sau:
Ca(OH)2 + CO2 → CaCO3 + H2O
0,05 51005100 = 0,05 mol
=> mC = 0,05 x 12 = 0,6 (g).
=> mO = 0,67 - (mC + mH) = 0
Từ đó tính được %mC = 89,55%; %mH = 10,45%.

Sản phẩm cháy thu được là dẫn qua bình (1) chứa H2SO4 đặc và bình (2) đựng nước vôi trong dư thì sản phẩm cháy bị hấp thụ hết
=> Sản phẩm cháy: CO2 và H2O
Khi dẫn sản phẩm cháy qua bình (1) thì H2O bị giữ lại trong bình, nên khối lượng bình tăng thêm chính bằng khối lượng nước
\(n_{H_2O}=\dfrac{6,3}{18}=0,35\left(mol\right)\)\(\Rightarrow n_H=0,7\left(mol\right)\)\(\Rightarrow m_H=0,7\left(g\right)\)
Dẫn tiếp qua bình (2) CO2 giữ lại trong bình,
\(CO_2\left(0,5\right)+Ca\left(OH\right)_2--->CaCO_3\left(0,5\right)+H_2O\)
\(n_{CaCO_3}=0,5\left(mol\right)\)
\(\Rightarrow n_{CO_2}=0,5\left(mol\right)\)\(\Rightarrow n_C=0,5\left(mol\right)\)\(\Rightarrow m_C=6\left(g\right)\)
Ta có: \(m_H+m_C=6,7\left(g\right)\)(đúng bằng khối lượng của Caroten)
\(\Rightarrow CTDC:C_xH_y\)
\(x:y=0,5:0,7=5:7\)
\(\Rightarrow CTTN:\left[C_5H_7\right]_n\)
\(\Leftrightarrow67n=536\)\(\Rightarrow n=8\)
\(\Rightarrow CTPT:C_{40}H_{56}\)

ản phẩm cháy thu được là dẫn qua bình (1) chứa H2SO4 đặc và bình (2) đựng nước vôi trong dư thì sản phẩm cháy bị hấp thụ hết
=> Sản phẩm cháy: CO2 và H2O
Khi dẫn sản phẩm cháy qua bình (1) thì H2O bị giữ lại trong bình, nên khối lượng bình tăng thêm chính bằng khối lượng nước
nH2O=6,318=0,35(mol)⇒nH=0,7(mol)⇒mH=0,7(g)
Dẫn tiếp qua bình (2) CO2 giữ lại trong bình,
CO2(0,5)+Ca(OH)2−−−>CaCO3(0,5)+H2O
nCaCO3=0,5(mol)n
⇒nCO2=0,5(mol)⇒nC=0,5(mol)⇒mC=6(g)
Ta có: mH+mC=6,7(g)(đúng bằng khối lượng của Caroten)
⇒CTDC:CxHy
x:y=0,5:0,7=5:7
⇒CTTN:[C5H7]n
⇔67n=536⇒n=8⇒
⇒CTPT:C40H56
Bạn tham khảo tại đây :Câu hỏi của Phan Dũng - Hóa học lớp 9 | Học trực tuyến
Khối lượng bình (1) tăng 0,63g chính là khối lượng H2O.
\(\Rightarrow m_H=\frac{0,63}{18}.2=0,07g\)
Ở bình (2) : \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
\(0,05\leftarrow\frac{5}{100}=0,05\)
\(\Rightarrow m_C=0,05.12=0,6g\)
\(\Rightarrow m_O=0,67-\left(m_C+m_H\right)=0\)
\(\Rightarrow\%m_C=\frac{0,6}{0,67}.100=89,55\%\)
\(\%m_H=100\%-89,55\%=10,45\%\)