Cho 34,4 gam hốn hợp A gồm Mg và Fe2O3 vào dung dịch H2SO4 100/0 loãng
vừa đủ . Sau phản ứng chỉ thu được dung dịch B và 2,24 lít một chất khí duy nhất (ở dktc)
a) Viết phương trình hóa học xảy ra
b) Tính phần trăm các chất có trong hỗn hợp A
c) Tính nồng độ phần trăm của các muối thu được trong dung dịch B


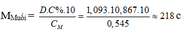
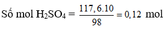
a, PT: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Mg}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1.24}{34,4}.100\%\approx6,98\%\\\%m_{Fe_2O_3}\approx93,02\%\end{matrix}\right.\)
c, Ta có: \(m_{Fe_2O_3}=34,4-0,1.24=32\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{MgSO_4}=n_{Mg}=0,1\left(mol\right)\\n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,2\left(mol\right)\end{matrix}\right.\)\(n_{H_2SO_4}=n_{Mg}+3n_{Fe_2O_3}=0,7\left(mol\right)\Rightarrow m_{H_2SO_4}=0,7.98=68,6\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{68,6}{10\%}=686\left(g\right)\)
Ta có: m dd sau pư = 34,4 + 686 - 0,1.2 = 720,2 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgSO_4}=\dfrac{0,1.120}{720,2}.100\%\approx1,67\%\\C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,2.400}{720,2}.100\%\approx11,11\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Giúp mình với