Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, \(n_{H_2}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\)
Theo PT: \(n_{Mg}=n_{MgCl_2}=n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow m_{Mg}=0,4.24=9,6\left(g\right)\)
c, \(m_{MgCl_2}=0,4.95=38\left(g\right)\)
d, Bạn bổ sung thêm thể tích dd HCl nhé.

Bài 13 :
\(a)n_{Fe_2O_3} = \dfrac{9,6}{160} = 0,06(mol)\\ Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2O\\ n_{HCl} = 6n_{Fe_2O_3} = 0,36(mol)\\ C\%_{HCl} = \dfrac{0,36.36,5}{150}.100\% = 8,76\%\\ \Rightarrow X = 8,76 b) n_{FeCl_3} = 2n_{Fe_2O_3} = 0,12(mol)\\ m_{FeCl_3} = 0,12.162,5 =19,5(gam)\)

a) \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,4-->0,6---------->0,2------->0,6
=> \(C_{M\left(dd.H_2SO_4\right)}=\dfrac{0,6}{0,15}=4M\)
b) VH2 = 0,6.22,4 = 13,44 (l)
c) \(C_{M\left(Al_2\left(SO_4\right)_3\right)}=\dfrac{0,2}{0,15}=\dfrac{4}{3}M\)
\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\\
pthh:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,4 0,6 0,2 0,6
\(C_M_{H_2SO_4}=\dfrac{0,6}{0,15}=4M\\ V_{H_2}=0,622,4=13,44L\)
\(C_M=\dfrac{0,2}{0,15}=1,3M\)

\(n_{NaOH}=0,2.4=0,8\left(mol\right)\)
PT: \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=0,4\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,4.98=39,2\left(g\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{39,2}{50}.100\%=78,4\%\)

a)Đổi \(V_{H_2SO_4}=100ml=0,1l\)
Số mol của 2,7 gam Al:
\(n_{Al}=\dfrac{m}{M}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)3+3H_2\)
Tỉ lệ 2 : 3 : 1 : 3
0,1 -> 0,15 : 0,05 : 0,15(mol)
Nồng độ mol của dung dịch H2SO4:
\(C_{M_{H_2SO_4}}=\dfrac{n_{H_2SO_4}}{V_{H_2SO_4}}=\dfrac{0,15}{0,1}=1,5\left(M\right)\)
b) thể tích của 0,15 mol H2:
\(V_{H_2}=n.22,4=0,15.22,4=3,36\left(l\right)\)
c) nồng độ mol của dd \(Al_2\left(SO_4\right)_3\) :
\(C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{n}{V}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)

nAl= 0,04(mol)
PTHH: 2 Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
0,04___________0,06___0,02_____0,06(mol)
a) V(H2, đktc)=0,06.22,4=1,344(l)
b) VddH2SO4= 0,06/2=0,03(l)=30(ml)
c) VddAl2(SO4)3=VddH2SO4=0,03(l)
=>CMddAl2(SO4)3=0,02/0,03=2/3(M)
\(n_{Al}=\dfrac{1.08}{27}=0.04\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(0.04......0.06.............0.02...........0.06\)
\(V_{H_2}=0.06\cdot22.4=1.344\left(l\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.06}{2}=0.03\left(l\right)\)
\(C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0.02}{0.03}=\dfrac{2}{3}\left(M\right)\)

sữa đề:
cho a(gam) Mg tác dụng vừa đủ với 500ml dung dịch H2SO4 thu đc b(gam)MgS04 với 2,479(lít) H2 đk chuẩn
a, viết pt
b, tính a(gam) và b (gam)
c, tính nồng độ mol dung dịch H2SO4 cần dùng
Giải
\(a,Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ b,n_{H_2}=\dfrac{2,479}{24,79}=0,1mol\\ n_{Mg}=n_{MgSO_4}=n_{H_2SO_4}=n_{H_2}=0,1mol\\ a=m_{Mg}=0,1.24=2,4g\\ b=m_{MgSO_4}=0,1.120=12g\\ c,C_{M_{H_2SO_4}}=\dfrac{0,1}{0,5}=0,2M\)

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3 0,3 0,3
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(m_{Fe}=0,3.56=16,8\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
\(C_{M_{FeSO_4}}=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
PTHH: Fe + H₂SO₄ --> FeSO₄ + H₂
200ml = 0,2 lít.
a) Số mol H₂: nH₂ = 6,72 ÷ 22,4 = 0,3 mol
Theo PTHH => Số mol Fe: nFe = 0,3 mol
=> Khối lượng Fe: mFe = 16,8g
b) Số mol H₂SO₄: nH₂SO₄ = 0,3 mol
Nồng độ mol dd: CM = 0,3 ÷ 0,2 = 1,5M

\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 0,2 0,2 0,2
a)\(V_{H_2}=0,2\cdot22,4=4,48l\)
b)\(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,5}=0,4M\)
c)\(C_{M_{FeSO_4}}=\dfrac{0,2}{0,5}=0,4M\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
pthh : \(Fe+H_2SO_4->FeSO_4+H_2\)
0,2 0,2
=> \(V_{H_2}=0,2.22,4=4,48\left(L\right)\)
\(m_{H_2SO_4}=\dfrac{0,5}{22,4}.98\approx2,188\left(g\right)\)
=> mdd=11,2+2,188=13,388(g)
C%=\(\dfrac{2,188}{13,388}.100\%=16,3\%\)
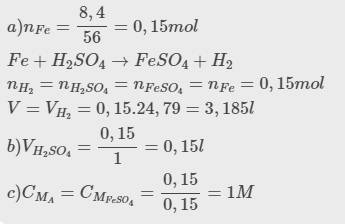
Sửa đề: 11,155 (l) → 11,1555 (l)
Ta có: \(n_{H_2}=\dfrac{11,1555}{24,79}=0,45\left(mol\right)\)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
____0,3_____0,45_________________0,45 (mol)
⇒ a = 0,3.27 = 8,1 (g)
\(C_{M_{H_2SO_4}}=\dfrac{0,45}{0,2}=2,25\left(M\right)\)