Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Hướng dẫn ![]() => A.x = 7y (1)
=> A.x = 7y (1)
M = ![]() = 46 => A.x + 16.y = 46 (2)
= 46 => A.x + 16.y = 46 (2)
Từ (1) và (2) => y=2 => A.x = 14
Với x=1 thỏa mãn A = 14 (N) => Hợp AxOY là NO2
Các phát biểu 1, 2, 4 đúng

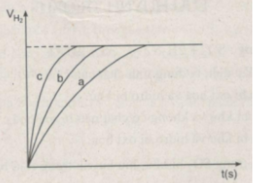
Thể tích khí hiđro :
Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng H 2 SO 4 tham gia phản ứng
n H 2 = n H 2 SO 4 = 2.50/1000 = 0,1 mol
Thể tích khí hiđro ở điều kiện phòng là :
V H 2 = 0,1 x 24 = 2,4l = 2400 cm 3
Ta ghi số 2400 cm 3 trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).

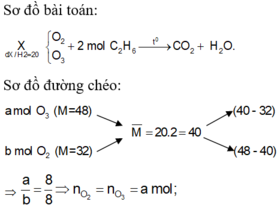
Ta có
`\overline(M)=(16V_1+28V_2)/(V_1+V_2)=26`
`=>10V_1=2V_2`
`=>V_1:V_2=2:10=1:5`
`->C`

a) \(\left\{{}\begin{matrix}24.n_{Mg}+27.n_{Al}=6,93\\\dfrac{n_{Mg}}{n_{Al}}=\dfrac{4}{5}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{Mg}=0,12\left(mol\right)\\n_{Al}=0,15\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Mg}=0,12.24=2,88\left(g\right)\\m_{Al}=0,15.27=4,05\left(g\right)\end{matrix}\right.\)
b)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,12->0,24
2Al + 6HCl --> 2AlCl3 + 3H2
0,15-->0,45
=> nHCl(min) = 0,24 + 0,45 =0,69 (mol)
=> \(V_{dd.HCl\left(min\right)}=\dfrac{0,69}{4}=0,1725\left(l\right)\)

Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà n N O 2 = 3 n H 2 n ê n n e n h ư ờ n g ( 1 ) = n N O 2 n e n h ư ờ n g ( 2 ) = 2 n H 2
Nên ne nhường(1) =3/2 ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
n e n h ư ờ n g ( 1 ) n e n h ư ờ n g ( 2 ) = n R . h o a t r i 1 n p . h o a t r i 2 = 3 2
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
m R S O 4 = 62 , 81 % m R ( N O 3 ) 2
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là: n NO2= 3nFe=9
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
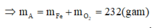
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
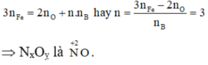
Khi đó:
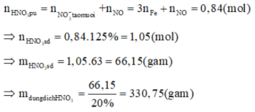



Ta có dA/B=\(\dfrac{M_A}{M_B}\)
lại có \(M=\dfrac{m}{n}\)và V tỉ lệ thuận với n
theo bài ra thể tích của hai khí A, B đều là V nên số mol của 2 khí là như nhau
=> dA/B=\(\dfrac{M_A}{M_B}\)\(=\dfrac{\dfrac{m_A}{n}}{\dfrac{m_B}{n}}=\dfrac{m_A}{m_B}\)
như vậy ý của bạn Vinh là đúng :v