Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a)n_{Al_2O_3}=\dfrac{102}{102}=1kmol\\ n_{Al\left(lt\right)}=1\cdot\dfrac{4}{2}=2kmol\\ m_{Al\left(lt\right)}=2.27=54kg\\ H=\dfrac{51,3}{54}\cdot100\%=95\%\\ b)n_{Al}=\dfrac{54}{27}=2kmol\\ n_{Al_2O_3\left(lt\right)}=2\cdot\dfrac{2}{4}=1kmol\\ m_{Al_2O_3\left(lt\right)}=1.102=102kg\\ m_{Al_2O_3\left(tt\right)}=\dfrac{102}{92\%}\cdot100\%\approx110,87kg\)

a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Gọi: mO2 = x (g) ⇒ mAl = 1,5x (g)
Theo ĐLBT KL, có: mAl + mO2 = mAl2O3
⇒ 1,5x + x = 10
⇒ x = 4 (g) = mO2
mAl = 1,5.4 = 6 (g)

\(n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\)
Pt : \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
0,02-->0,015-->0,01
a) \(m_{Al2O3}=0,01.102=1,02\left(g\right)\)
b) \(V_{O2\left(dktc\right)}=0,015.24,79=0,37185\left(l\right)\)
sửa lại \(V_{\left(dktc\right)}-->V_{\left(dkc\right)}\)

a. Aluminium + Khí oxygen -> Aluminium oxide
b. \(m_{Al}+m_O=m_{Al_{2_{ }}O_3}\)
c. Từ câu b => \(m_{Al}=m_{Al_{2_{ }}O_3}-m_O=20.4-9.6=10.8\)
Phương trình chữ:
aluminium + oxygen \(\rightarrow\) aluminium oxide
Biểu thức khối lượng:
\(m_{Al}+m_{O_2}=m_{Al_2O_3}\)
Khối lượng aluminium:
\(m_{Al}=m_{Al_2O_3}-m_{O_2}=20,4-9,6=10,8g\)

1. Theo ĐLBT KL, có: mAl + mO2 = mAl2O3
2. \(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{Al_2O_3}=0,15\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,15.32=4,8\left(g\right)\)

\(1,PTHH:4Al+3O_2\rightarrow^{t^o}2Al_2O_3\\ \Rightarrow\text{Số nguyên tử Al }:\text{ số nguyên tử O}=4:3\\ 2,\text{Bảo toàn KL: }m_{O_2}=m_{Al_2O_3}-m_{Al}=9,6\left(g\right)\)

Phương trình chữ:
Aluminium + oxygen \(\rightarrow\) aluminium oxide
Bảo toàn khối lượng:
\(m_{Al}+m_{O_2}=m_{Al_2O_3}\)
\(\Rightarrow m_{Al}=20,4-10,8=9,6g\)
\(PTHH:4Al+3O_2\rightarrow^{t^o}2Al_2O_3\\ \text{Đ}LBTKL:\\ m_{Al}+m_{O_2}=m_{Al_2O_3}\\ \Leftrightarrow10,8+m_{O_2}=20,4\\ \Leftrightarrow m_{O_2}=9,6\left(g\right)\)
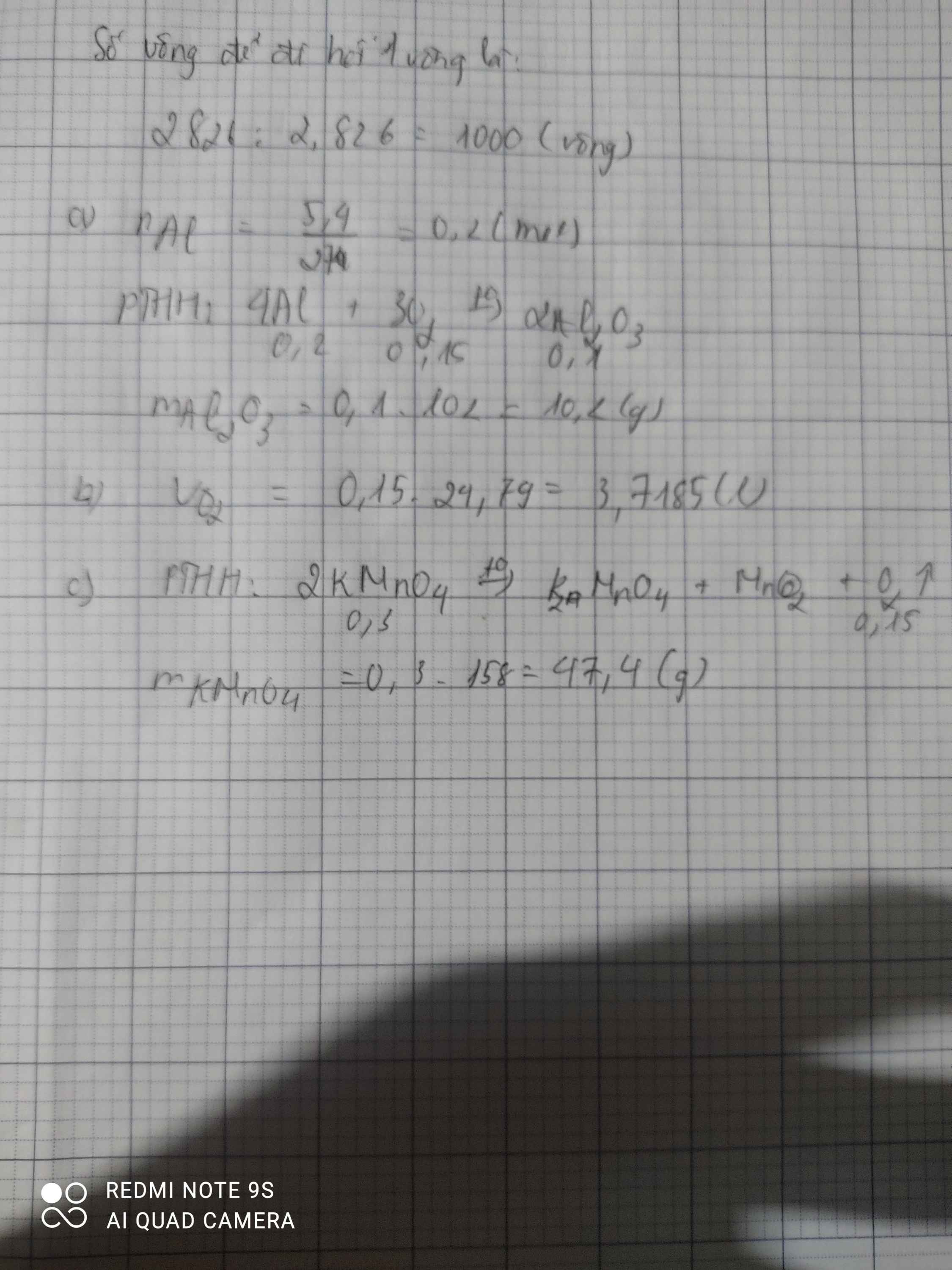
\(n_{Al}=\dfrac{27.1000}{27}=1000\left(kmol\right)\)
\(Al_2O_3\xrightarrow[criolic]{đpnc}2Al+3O_2\)
500<------1000 (kmol)
\(m_{Al_2O_3\left(lý.thuyết\right)}=500.102=51000\left(kg\right)\)
H% = 85% => \(m_{Al_2O_3\left(thực.tế\right)}=\dfrac{51000.100\%}{85\%}=60000\left(kg\right)=60\left(tấn\right)\)