Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1) MM= \(\dfrac{m}{n}\)=\(\dfrac{11,5}{0,5}\)= 23(g/mol)
2) Gọi oxit sắt có 70% sắt là FexOy
=> \(\dfrac{56x}{56x+16y}.100=70\)
<=> 56x = 39,2x + 11,2y
<=> 16,8x = 11,2y
<=> x:y = 2:3
=> Công thức hóa học của oxit sắt là Fe2O3

a) PTHH:
CuO + H2 =(nhiệt)=> Cu + H2O (1)
Fe2O3 + 3H2 =(nhiệt)=> 2Fe + 3H2O (2)
b) - Dựa vào định nghĩa chất khử và chất oxi hóa
=> Chất khử: H2
Chất Oxi hóa: CuO và Fe2O3
c) Lượng đồng có trong 6g hỗn hợp 2 kim loại thu được:mCu = 6g - 2,8g = 3,2g.
VH2 cần dùng theo phương trình phản ứng(1) = \(\dfrac{3,2}{64}\cdot64=1,12\left(l\right)\) =
VH2 cần dùng theo phương trình phản ứng(2) = \(\dfrac{2,8}{56}\cdot\dfrac{3}{2}\cdot22,4=1,68\left(l\right)\)
a.Phương trình phản ứng:
CuO + H2 Cu + H2O (1)
1mol 1mol 1mol 1mol
Fe2O3 + 3H2 3H2O + 2Fe (2)
1mol 3mol 3mol 2mol
b. + Chất khử là H2 vì chiếm oxi của chất khác;
+ Chất oxi hóa: CuO, Fe2O3 vì nhường oxi cho chất khác.
c. Số mol đồng thu được là: nCu = = 0,5 (mol)
Số mol sắt là: nFe = = 0,05 (mol)
Thể tích khí H2 cần dùng để khử CuO theo phương trình phản ứng (1) là: nH2 = nCu = 0,05 mol => VH2 = 22,4.0,05 = 1,12 (lít)
Khí H2 cần dùng để khử Fe2O3 theo phương trình phản ứng (2) là:
nH2 = nFe =
.0,05 = 0,075 mol
=>VH2(đktc) = 22,4.0,075 = 1,68 (lít)

Gọi CTTQ : FexOy (x,y: nguyên, dương)
mFe= 70% . 160=112 => x=nFe=112/56=2
mO=160-112=48 -> y=nO=48/16=3
Với x=2;y=3 -> CTHH oxit sắt: Fe2O3

công thức của oxit sắt là: FexOy
M(Fe)= 160*70/100 = 112 =>x= 112/56= 2
M(O)= 160-112= 48 => y= 48/16= 3
Vậy ta có công thức là: Fe2O3

a) Phương trình hóa học của các phản ứng:
H2 + CuO → Cu + H2O (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Trong phản ứng (1), (2) chất khử H2 vì chiếm oxi của chất khác, chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
c) Khối lượng đồng thu được từ 6g hỗn hợp 2 kim loại thu được:
mCu = 6g - 2,8g = 3,2g, nCu = 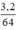 = 0,05 mol
= 0,05 mol
nFe = 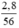 = 0,05 (mol)
= 0,05 (mol)
nH2 (1) = nCu = 0,05 mol ⇒ VH2(1) = 22,4 . 0,05 = 1,12 lít
nH2 (2) = 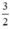 . nFe =
. nFe = 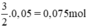 ⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
VH2 = VH2(1) + VH2(2) = 1,12 + 1,68 = 2,8(l)

1. CO3 = 12+ 16.3 = 60g
kim loại đó mkl = 40% = 40g = Ca
PO4 = 31 + 16.4 = 95
% Ca = 40/(95+40).100% = 29,6%
2. % Fe trong fe0 = 56/(56+16) = 77,41%
vay nó là FeO

Ta có :
\(n_{Fe_2O_3}=\frac{32}{160}=0,2\left(mol\right)\)
\(n_{CO_2}=\frac{26,4}{44}=0,6\left(mol\right)\)
PTHH: Fe2O3 + 3CO \(\rightarrow\) 2Fe + 3CO2
1mol 2mol 3mol
0,2mol 0,4mol 0,6mol (đủ)
Từ PT \(\Rightarrow\) nFe = 0,4 (mol)
mFe = 0,4.56 = 22,4 (kg)
pt hh: Fe2O3 + 3CO = 2Fe + 3CO2
Cứ 112g Fe sinh ra 132g CO2
vậy x g......................26,4kg.....
x = Fe =112.26,4/132 = 22,4kg
( Tự làm ráng kiếm cái giải khổ quá thầy à)
Gọi công thức hoá học của ôxit sắt cần tìm là: FexOy
- Theo đề bài ra ta có: 56x / 56x + 16y = 70%
<=> 5600x = 3920x + 1120y
<=> 1680x = 1120y
<=> x / y = 1120 / 1680
<=> x / y = 2 / 3
=> Công thức hoá học của ôxit sắt cần tìm là: Fe2O3
là sao?