
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Phương pháp điều chế clo trong phòng thí nghiệm: Đun nóng nhẹ dung dịch HCl đậm đặc với chất oxi hóa mạnh như MnO2 (hoặc KMnO4).
MnO2 + 4HCl \(\underrightarrow{t^o}\) MnCl2 + Cl2 + 2H2O
Để thu được khí clo tinh khiết:
- Bình H2SO4 đặc có tác dụng làm khô khí clo.
- Clo nặng hơn không khí Þ Thu bằng cách đẩy không khí.
- Bông tẩm xút: tránh để clo độc bay ra ngoài.

2NaCl + 2H2O \(\underrightarrow{đpddcmn}\) 2NaOH + H2 + Cl2
2NaCl \(\underrightarrow{đpnc}\) 2Na + Cl2
MnO2 + 4HCl \(\rightarrow\) MnCl2 + 2H2O + Cl2
Chúng ta có thể điều chế clo bằng cách cho những chất có tính oxi hóa mạnh tác dụng với hợp chất của clo
VD: 6HCl+KClO3→3Cl2+3H2O+KCl
4HCl+MnO2→Cl2+2H2O+MnCl2
16HCl+2KMnO4→5Cl2+8H2O+2KCl+2MnCl2

Trong công nghiệp, clo được điều chế bằng phương pháp điện phân dung dịch NaCl bão hòa có màng ngăn.
Đáp án: A

Nguyên liệu chính là: \(CaC_2;CH_4\)
\(CaC_2+2H_2O\rightarrow C_2H_2+Ca\left(OH\right)_2\)
\(2CH_4\rightarrow\left(t^o,làmlạnhnhanh\right)C_2H_2+3H_2\)

Phương pháp điều chế Clo trong phòng thí nghiệm
4HCl(dd đặc) +MnO2 -----------> MnCl2+ Cl2↑ +2H2O

a) MgCO3 \(\underrightarrow{t^o}\) MgO + CO2
- Dẫn khí sinh ra đi qua dd Ca(OH)2, nếu dung dịch có vẩn đục thì đó là khí CO2
PTHH:
CO2 + Ca(OH)2 \(\rightarrow\)CaCO3\(\downarrow\) + H2O
b) 2HCl + Fe \(\rightarrow\) FeCl2 + H2
- Dẫn khi sinh ra đi qua bình đựng CuO đã nung nóng
Nếu chất rắn trong bình chuyển từ đen sang cam đỏ thì đó là do H2
PTHH:
H2 + CuO \(\rightarrow\) Cu + H2O
c) 2KMnO4 \(\underrightarrow{t^o}\) K2MnO4 + MnO2 + O2
- Dẫn khi sinh ra sau phản ứng vào một ống nghiệm, cho que đóm còn tàn đỏ vào miệng ống nghiệm, nếu que đóm bùng cháy thì đó là O2
a) \(CaCO_3\underrightarrow{t^0}CaO+CO_2\)
- Ta thu được khí CO2
b) \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
- Thu được khí Hidro
c) \(KMnO4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
- Thu được khí O2

Những oxit bị khử là: Fe3O4, CuO
Pt: Fe3O4 + 4H2 → 3Fe + 4H2O
CuO + H2 → Cu + H2O
Chú ý: Nhiệt luyện là phương pháp dùng (H2, CO) khử các oxit kim loại trung bình (–K, Na, Ca, Ba, Mg, Al)
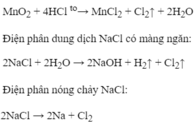
*Điều chế khí Clo
+) Điện phân dd muối ăn bão hòa trong bình điện phân có màng ngăn
2NaCl + 2H2O -> 2NaOH + Cl2 + H2
+) Các pư hóa học khác:
MnO2 + 4HCl (đặc) -> MnCl2 + Cl2 + 2H2O (đk: to)
2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
_Trong phòng thí nghiệm:
Mn02+4HCl(đặc)=>MnCl2+Cl2+2H20
2KMn04+16HCl(đặc)=>2KCl+2MnCl2+5Cl2+8H2...
K2Cr207+14HCl(đặc)=>2KCl+2MnCl2+4Cl2+7H...
KCl03+6HCl(đặc)=>KCl+3Cl2+3H20
CaOCl2+2HCl=>CaCl2+Cl2+H20
2AgCl(ánh sáng)=>2Ag+Cl2
_Trong công nghiệp:
2NaCl+2H20(đpcmn)=>2NaOH+Cl2+H2
2HCl(nhiệt phân)=>H2+Cl2