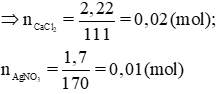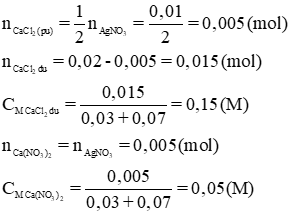Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình phản ứng
CaCl2 (dd) + 2AgNO3 -> 2AgCl (r ) + Ca(NO3)2 (dd)
a) Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là AgCl
b) Đáp số
mAgCl=1,435 gam
c) Trong 30 + 70 = 100 (ml) dd sau phản ứng có chứa 0,02 – 0,05 =0,015 (mol) CaCl2 dư và 0,005 mol Ca(NO3)2
Do vậy ta có
CMCaCl2=0,15M và CMCa(NO3)2 = 0,05 M.
a) Phương trình phản ứng CaCl2(dd) + 2AgNO3 → 2AgCl (r) + Ca(NO3)2 (dd)
Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là AgCl
b) MCaCl2 = 40 + 35,5. 2 = 111g/mol ; MAgNO3 = 108 + 14 + 16.3 = 170g / mol
Tỉ lệ mol: 0,02/1 > 0,01/2 ⇒ AgNO3 phản ứng hết, CaCl2 dư.
Theo pt: nAgCl = nAgNO3 = 0,01 (mol) ⇒ mAgCl = 0,01. 143,5 = 1,435 (g)
c) Chất còn lại sau phản ứng: Ca(NO3)2 và CaCl2 dư
Theo pt:

a) dung dịch xuất hiện kết tủa trắng ( AgCl )
CaCl2 + 2AgNO3 --> Ca(NO3)2 + 2AgCl
b)
CaCl2 + 2AgNO3 --> Ca(NO3)2 + 2AgCl
Tpu 0.02 0.01
Pu 0.005 0.01 0.01 0.02
Spu 0.015 0.01 0.02
n CaCl2= m/M= 2.22/ 111= 0.02 (mol)
n AgNO3= 1.7 / 170= 0.01 (mol)
Ta có: 0.02/ 1 > 0.01/ 2 => CaCl2 dư, AgNO3 hết
m AgCl = 0.02 * 143.5 = 2.87 (g) => m kết tủa = 2.87 g
c) Tổng thể tích 2 dung dịch là:
V = 0.03 + 0.07= 0.1 ( lít )
Nồng độ mol của dung dịch CaCl dư:
CM ( CaCl2 ) = 0.015/ 0.1 = 0.15 M
Nồng độ mol của dung dịch Ca(NO3) tạo thành sau phản ứng là:
CM [ Ca(NO3)2 ] = 0.01/ 0.1 = 0.1 M

CaCl2+2AgNO3---->Ca(NO3)2+2AgCl
nCaCl2=0,04(mol)
n\(_{AgNO3}=\frac{3,4}{170}=0,02\left(mol\right)\)
=> CaCl2 dư
=> PƯ xảy ra hoàn toàn..K có chất dư sau pư
a) Ht : Có chất rắn màu trắng sau pư
b) Theo pthh
n\(_{AgCl}=n_{AgNO3}=0,02\left(mol\right)\)
m AgCl=0,02.179=3,58(g)
m\(_{Ca\left(NO3\right)2}=\)0,04.164=6,56(g)
m\(_{CaCl2}dư=0,03.111=3,33\left(g\right)\)
b)V dd=200ml=0,2l
CM CaCl2=\(\frac{0,03}{0,2}=0,15\left(M\right)\)
CM Ca(NO3)2=\(\frac{0,04}{0,2}=0,2\left(M\right)\)

CaCl\(_2\)+ 2AgNO\(_3\)\(\)--> 2AgCl + Ca(NO\(_3\))\(_2\)
n\(_{CaCl2}\)=0.02 mol
a) theo pthh nAgCl=2nCaCl2=0.04 mol
m\(_{r\text{ắn}}\)= 0.04\(\)*143.5=5.74g
b) nCa(NO3)2=nCaCl2=0.02 mol
CM=\(\frac{0.02}{0.03+0.07}\)=0.2M
a) CaCl2 + 2AgNO3 -> Ca(NO3)2 + 2AgCl
0,02 0,04 0,02 0,04
nCaCl2 = 2,22 / 111 = 0,02 (mol)
m rắn (AgCl) = 0,04 x 143,5 = 5,74 (g)
b) V dd = 30 + 70 = 100 (ml)
Đổi : 100 ml = 0,1 l
Cm Ca(NO3)2 = 0,02 / 0,1 = 0,2 M

nAgNO3 = 0,4 mol
nCaCl2 = 0,45 mol
Pt: CaCl2 + 2AgNO3 --> 2AgCl + Ca(NO3)2
.....0,2<--------0,4--------> 0,4--------> 0,2
Xét tỉ lệ mol giữa CaCl2 và AgNO3:
\(\dfrac{0,45}{1}>\dfrac{0,4}{2}\)
Vậy CaCl2 dư
mAgCl = 0,4 . 143,5 = 57,4 (g)
CM CaCl2 dư = \(\dfrac{0,45-0,2}{0,5}=0,5\left(M\right)\)
CM Ca(NO3)2 = \(\dfrac{0,2}{0,5}=0,4\left(M\right)\)

nAgNO3= 0,4(mol) ; nCaCl2= 0,45(mol)
a) 2AgNO3+ CaCl2 \(\rightarrow\) Ca(NO3)2 + 2AgCl\(\downarrow\) ( \(\dfrac{0,4}{2}=0,2< \dfrac{0,45}{1}=0,45\) nên CaCl2 dư, tính theo AgNO3
0,4\(\rightarrow\) 0,2\(\rightarrow\) 0,2\(\rightarrow\) 0,4
mAgCl2= 0,4.179=71,6(g)
c) dd sau pư gồm CaCl2 dư, Ca(NO3)2.
nCaCl2 dư= 0,45 - 0,2= 0,25(mol)
Vdd sau pư= 0,3 +0,2= 0,5(mol)
CM CaCl2= \(\dfrac{0,25}{0,5}\)=0,5 M
CM Ca(NO3)2 = \(\dfrac{0,2}{0,5}\)=0,4M