Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nAgNO3= 0,4(mol) ; nCaCl2= 0,45(mol)
a) 2AgNO3+ CaCl2 \(\rightarrow\) Ca(NO3)2 + 2AgCl\(\downarrow\) ( \(\dfrac{0,4}{2}=0,2< \dfrac{0,45}{1}=0,45\) nên CaCl2 dư, tính theo AgNO3
0,4\(\rightarrow\) 0,2\(\rightarrow\) 0,2\(\rightarrow\) 0,4
mAgCl2= 0,4.179=71,6(g)
c) dd sau pư gồm CaCl2 dư, Ca(NO3)2.
nCaCl2 dư= 0,45 - 0,2= 0,25(mol)
Vdd sau pư= 0,3 +0,2= 0,5(mol)
CM CaCl2= \(\dfrac{0,25}{0,5}\)=0,5 M
CM Ca(NO3)2 = \(\dfrac{0,2}{0,5}\)=0,4M

CaCl2+2AgNO3---->Ca(NO3)2+2AgCl
nCaCl2=0,04(mol)
n\(_{AgNO3}=\frac{3,4}{170}=0,02\left(mol\right)\)
=> CaCl2 dư
=> PƯ xảy ra hoàn toàn..K có chất dư sau pư
a) Ht : Có chất rắn màu trắng sau pư
b) Theo pthh
n\(_{AgCl}=n_{AgNO3}=0,02\left(mol\right)\)
m AgCl=0,02.179=3,58(g)
m\(_{Ca\left(NO3\right)2}=\)0,04.164=6,56(g)
m\(_{CaCl2}dư=0,03.111=3,33\left(g\right)\)
b)V dd=200ml=0,2l
CM CaCl2=\(\frac{0,03}{0,2}=0,15\left(M\right)\)
CM Ca(NO3)2=\(\frac{0,04}{0,2}=0,2\left(M\right)\)

2.
a)
+nFe2(SO4)3 = 0.1*2 = 0.2 (mol)
+nBa(OH)2 = 0.15*1.5 = 0.225 (mol)
3Ba(OH)2 + Fe2(SO4)3 => 2Fe(OH)3↓ + 3BaSO4↓(1)
0.225...................0.2.................
2Fe(OH)3(t*) => Fe2O3 + 3H2O(2)
0.15.........................0.075...........
_Dựa vào phương trình (1) ta thấy Fe2(SO4)3 còn dư 0.125 mol => dd(B) : Fe2(SO4)3
Fe2(SO4)3 + 3BaCl2 => 3BaSO4↓ + 2FeCl3
0.125..................0.375............0.375
b)
_Chất rắn (D) : Fe2O3 và BaSO4 không bị phân hủy.
=>m(D) = mFe2O3 + mBaSO4 = 0.075*160 + 0.375*233 = 99.375(g)
_Chất rắn (E) : BaSO4
=>m(E) = mBaSO4 = 0.375*233 = 87.375(g)
c)
_Dung dịch (B) : Fe2(SO4)3
=>Vdd(sau) = 150 + 100 = 250 (ml) = 0.25 (lit)
=>nFe2(SO4)3 (dư) = 0.125 (mol)
=>CM(Fe2(SO4)3) = 0.125 / 0.25 = 0.5 (M)

Phương trình phản ứng
CaCl2 (dd) + 2AgNO3 -> 2AgCl (r ) + Ca(NO3)2 (dd)
a) Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là AgCl
b) Đáp số
mAgCl=1,435 gam
c) Trong 30 + 70 = 100 (ml) dd sau phản ứng có chứa 0,02 – 0,05 =0,015 (mol) CaCl2 dư và 0,005 mol Ca(NO3)2
Do vậy ta có
CMCaCl2=0,15M và CMCa(NO3)2 = 0,05 M.
a) Phương trình phản ứng CaCl2(dd) + 2AgNO3 → 2AgCl (r) + Ca(NO3)2 (dd)
Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là AgCl
b) MCaCl2 = 40 + 35,5. 2 = 111g/mol ; MAgNO3 = 108 + 14 + 16.3 = 170g / mol
Tỉ lệ mol: 0,02/1 > 0,01/2 ⇒ AgNO3 phản ứng hết, CaCl2 dư.
Theo pt: nAgCl = nAgNO3 = 0,01 (mol) ⇒ mAgCl = 0,01. 143,5 = 1,435 (g)
c) Chất còn lại sau phản ứng: Ca(NO3)2 và CaCl2 dư
Theo pt:

Bài 6. Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dần khí X vào 500 ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Trả lời:
MnO2+4HCl→MnCl2+Cl2+2H2OnMnO2=nCl2=0,8molCl2+2NaOH→NaCl+NaClO+H2OnNaOHpu=0,5×2=1,6molnNaOHhd=0,5×4=2molnNaOHdu=2−1,6=0,4molnNaCl=nCl2=nNaClO=0,8molCNaCl=0,80,5=1,6MVNaClO=0,80,5=1,6MCNaOH=0,40,5=0,8M

bài 1:
- Trích mỗi chất 1 ít làm mẫu thử
- Nhỏ vài giọt các dd trên vào mẫu giấy quỳ tím
+ quỳ tím chuyển sang xanh : Ba(OH)2 , NaOH (I)
+ Không có hiện tượng gì : NaCl , Na2SO4 (II)
- Trích từng chất dd ở nhóm I vào nhóm II , thấy xuất hiện kết tủa trắng thì đó là Ba(OH)2 và Na2SO4
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
- Hai dd còn lại là NaCl(không làm quỳ tím đổi màu)
Và NaOH ( quỳ làm tím hóa xanh )

a) PTHH: Na2O + H20 -> 2NaOH
số mol Na20 = 0,25 (mol)
=> số mol NaOH = 0,5 mol.
Nôngd độ mol NaOH = 0,5 / 0,5 = 1 M
b) PTHH: H2SO4 + 2NaOH -> Na2SO4 + 2H2O
số mol H2SO4 = 1/2 số mol NaOH = 0,25 mol
C% H2SO4 = mH2SO4 / m ddH2SO4 . 100%
=> m ddH2SO4= 122,5 g
D=m/V => V= 107,5 ml
Số mol Na2O = 15,5:62 = 0,25 mol
a) Khi cho Na2O xảy ra phản ứng, tạo thành phản ứng dung dịch có chất tan là NaOH.
Na2O + H2O → 2NaOH
Phản ứng: 0,25 → 0,05 (mol)
500 ml = = 0,5 lít; CM, NaOH =
= 1M.
b) Phương trình phản ứng trung hòa dung dịch:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Phản ứng: 0, 5 → 0,25 0,25 (mol)
mH2SO4 = 0,25x98 = 24,5 g
mdd H2SO4 = = 122,5 g
mdd, ml = =
≈ 107,5 ml

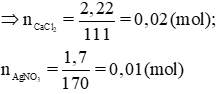
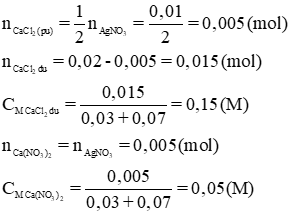

 ok
ok
nAgNO3 = 0,4 mol
nCaCl2 = 0,45 mol
Pt: CaCl2 + 2AgNO3 --> 2AgCl + Ca(NO3)2
.....0,2<--------0,4--------> 0,4--------> 0,2
Xét tỉ lệ mol giữa CaCl2 và AgNO3:
\(\dfrac{0,45}{1}>\dfrac{0,4}{2}\)
Vậy CaCl2 dư
mAgCl = 0,4 . 143,5 = 57,4 (g)
CM CaCl2 dư = \(\dfrac{0,45-0,2}{0,5}=0,5\left(M\right)\)
CM Ca(NO3)2 = \(\dfrac{0,2}{0,5}=0,4\left(M\right)\)