Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl=0,03.8=0,24(mol)
Đặt oxit hóa trị II là AO
PTHH: AO +2 HCl -> ACl2 + H2O
0,12____0,24___0,12(mol)
=>M(AO)=4,8/0,12= 40(g/mol)
Mặt khác: M(AO)=M(A)+16(g/mol)
=>M(A)+16=40
<=>M(A)= 24(g/mol)
=>A là magie (Mg=24)=> CTHH oxit MgO

\(Đăt:A\left(II\right)\\ AO+2HCl\rightarrow ACl_2+H_2O\\ n_{HCl}=\dfrac{100.14,6\%}{36,5}=0,4\left(mol\right)\\ n_{AO}=\dfrac{0,4}{2}=0,2\left(mol\right)\\ M_{AO}=\dfrac{4,8}{0,2}=24\left(\dfrac{g}{mol}\right)\)
Em coi đề lại nha

1.
Gọi CTHH của HC là R2O3
R2O3 + 3H2SO4 -> R2(SO4)3 + 3H2O
nH2SO4=\(\dfrac{294.10\%}{98}=0,3\left(mol\right)\)
Theo PTHH ta có:
nR2O3=\(\dfrac{1}{3}\)nH2SO4=0,1(mol)
MR2O3=10,2:0,1=102
=>MR=\(\dfrac{102-16.3}{2}=27\)
Vậy R là Al
CTHH của HC là Al2O3

- Đặt công thức hóa học của kim loại cần tìm là: RO.
- Phương trình hóa học của phản ứng:
RO + 2HCl --> RCl2 + H2O
nHCl = \(\dfrac{30\times14,6\%}{36,5}\) = 0,12 mol
- Số mol oxit : nRO = 0,12 : 2 = 0,06 mol
- Khối lượng mol của oxit là 4,8 : 0,06 = 80g
- PTK của oxit là RO = 80
- Nguyên tử khối của R bằng: 80 – 16 = 64 đvc.
Vậy R là Cu. Oxit cần tìm là CuO.

Đặt kim loại là M, oxit là MO
Giả sử có 1 mol MO phản ứng, 1 mol H2SO4 phản ứng:
MO + H2SO4 -> MSO4 + H2O
C% = mct / mdd . 100%
10% = 1 . 98 / mdd . 100%
-> mDd H2SO4 = 980 g
Theo định luật bảo toàn khối lượng ta có:
Mdd = mMO + mddH2SO4 = (M + 16) + 980
= M + 996
C%muối = m chất tan muối/ m dd muối . 100%
15.17% = (M + 96) / (M + 996) * 100%
M = 64.95 g
M là Zn
Công thức oxit ZnO

a)Giả sử có 1 mol MO phản ứng
\(MO+2HCl\rightarrow MCl_2+H_2O\)
1----------->2----------->1----------->1
=> \(m_{ddHCl}=\dfrac{2.36,5}{10\%}=730\left(g\right)\)
\(m_{ddsaupu}=\left(M+16\right)+730=M+746\left(g\right)\)
=> \(C\%_{MCl_2}=\dfrac{M+71}{M+746}.100=12,34\)
=> M=24 (Mg)
b) Giả sử có 1 mol M2On phản ứng
\(M_2O_n+2nHCl\rightarrow2MCl_n+nH_2O\)
1---------------->2n-------------->2----------->n
=> \(m_{ddHCl}=\dfrac{2n.36,5}{10\%}=730n\left(g\right)\)
\(m_{ddsaupu}=\left(2M+16n\right)+730n=2M+746n\left(g\right)\)
=> \(C\%_{MCl_2}=\dfrac{2\left(M+35,5n\right)}{2M+746n}.100=12,34\)
Chạy nghiệm n=1,2,3
n=1 => M=12 (loại)
n=2 => M=24 (Mg)
n=3 => M=36 (loại)

1. Phương trình phản ứng điều chế xút từ vôi sống và sô đa :
- CaO + H2O --> Ca(OH)2
- Ca(OH)2 + Na2CO3 --> CaCO3 + 2NaOH.
2. - Đặt công thức hóa học của kim loại cần tìm là: RO.
- Phương trình hóa học của phản ứng:
RO + 2HCl --> RCl2 + H2O
- Số mol axit HCl: nHClnHCl = 30.14,6100.36,530.14,6100.36,5 = 0,12 mol
- Số mol oxit : nROnRO = 0,12 : 2 = 0,06 mol
- Khối lượng mol của oxit là 4,8 : 0,06 = 80g
- PTK của oxit là RO = 80
- Nguyên tử khối của R bằng: 80 – 16 = 64 đvc.
Vậy R là Cu. Oxit cần tìm là CuO.
bài 1:
Phương trình phản ứng điều chế xút từ vôi sống và sô đa
- CaO + H2O \(\rightarrow\)Ca(OH)2
- Ca(OH)2 + Na2CO3 (sô đa) \(\rightarrow\) CaCO3 + 2NaOH.

Gọi công thức tổng quát oxit đó là A2O3
A2O3+6HNO3->2A(NO3)3+3H2O
nHNO3=2.4(mol)
nA2O3=0.4(mol)
MA2O3=64:0.4=160(g/mol)
MA=(160-48):2=56(g/mol)
->Kim loại đó là Fe
CTHH của oxit đó là Fe2O3
nFe(NO3)3=0.8(mol)
CM=0.8:0.8=1(M)

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
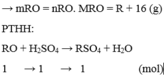
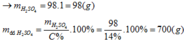
![]()
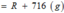
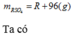

Vậy công thức của oxit kim loại là MgO
lại war
Như Khương Nguyễn học lớp mấy v nhỉ??
Chữa lại đề :
Bài 2: Lập công thức hóa học của một oxit kim loại hóa trị II biết rằng cứ 30g dung dịch HCl nồng độ 14,6% thì hòa tan hết 4,8g oxit đó.
---------------------------------------------B
ài làm ---------------------------------------Gọi tên kim loại có hóa trị II là M
Gọi CTHH TQ của oxit kim loại có hóa trị (II) là MO
Theo đề bài ta có :
nHCl=\(\dfrac{30.14,6}{100.36,5}=0,12\left(mol\right)\)
Ta có pthh :
MO + 2HCl \(\rightarrow\) MCl2 + H2O
0,06mol...0,12mol
=> MMO = \(\dfrac{m}{n}=\dfrac{4,8}{0,06}=80\left(\dfrac{g}{mol}\right)\)
Ta có :
MMO = MM + MO
=> MM = MMO - MO = 80-16=64(g/mol)
Vậy kim loại M cần tìm hóa trị II là Cu
CTHH của oxit là CuO