Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nO2 = 6.72/22.4 = 0.3 (mol)
BTKL :
mKMnO4 = 116.8 + 0.3*32 = 126.4 (g)
nKMnO4 = 126.4/158 = 0.8 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.6_________________________0.3
H% = 0.6/0.8 * 100% = 75%

$PTHH : 2KMnO_4 \xrightarrow[]{t^o} K_2MnO_4+MnO_2+O_2 \\ n_{O_2} = \dfrac{1,68}{22,4} = 0,075(mol) \\ n_{KMnO_4} = 2n_{O_2} = 0,15(mol) \\ m_{KMnO_4} = 0,15.158 = 23,7(gam) $
H% =( 23,7 : 31,6).100 = 75%

PTHH :
2KMnO4 -----> K2MnO4 + MnO2 + O2
x...........................x/2...............x/2............x/2
Gọi x là số mol KMnO4 phản ứng
=> mK2MnO4 = 98,5x (g)
mMnO2 = 43,5x (g)
mKMnO4 (dư) = 31,6 - 158x (g)
=> mCR (sau) = 98,5x + 43,5x + 31,6 - 158x
=> 29,04 = -16x + 31,6
=> 2,56 = 16x
=> 0,16 = x (mol)
Theo đề bài :
mKMnO4 = 31,6 (g)
=> nKMnO4 = 31,6 : 158 = 0,2 (mol)
=> H% = 0,16 : 0,2 . 100% = 80 %
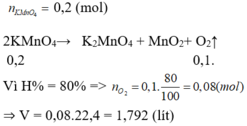
\(2KMnO_4-t^o->K_2MnO_4+MnO_2+O_2\)
Chất rắn là K2MnO4 và MnO2
\(n_{KMnO_4}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
\(n_{K_2MnO_4}\left(lt\right)=0,05\left(mol\right)\)
\(n_{MnO_2}\left(lt\right)=0,05\left(mol\right)\)
Vì \(H=75\%\)
\(\Rightarrow n_{K_2MnO_4}\left(tt\right)=0,035\left(mol\right)\)
\(\Rightarrow n_{MnO_2}\left(tt\right)=0,035\left(mol\right)\)
khối lượng chất rắn thu được sau phản ứng
\(m chất rắn =0,035.197+0,035.87=9,94(g)\)