Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nO2 = 6.72/22.4 = 0.3 (mol)
BTKL :
mKMnO4 = 116.8 + 0.3*32 = 126.4 (g)
nKMnO4 = 126.4/158 = 0.8 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.6_________________________0.3
H% = 0.6/0.8 * 100% = 75%

$PTHH : 2KMnO_4 \xrightarrow[]{t^o} K_2MnO_4+MnO_2+O_2 \\ n_{O_2} = \dfrac{1,68}{22,4} = 0,075(mol) \\ n_{KMnO_4} = 2n_{O_2} = 0,15(mol) \\ m_{KMnO_4} = 0,15.158 = 23,7(gam) $
H% =( 23,7 : 31,6).100 = 75%

\(2KMnO_4-t^o->K_2MnO_4+MnO_2+O_2\)
Chất rắn là K2MnO4 và MnO2
\(n_{KMnO_4}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
\(n_{K_2MnO_4}\left(lt\right)=0,05\left(mol\right)\)
\(n_{MnO_2}\left(lt\right)=0,05\left(mol\right)\)
Vì \(H=75\%\)
\(\Rightarrow n_{K_2MnO_4}\left(tt\right)=0,035\left(mol\right)\)
\(\Rightarrow n_{MnO_2}\left(tt\right)=0,035\left(mol\right)\)
khối lượng chất rắn thu được sau phản ứng
\(m chất rắn =0,035.197+0,035.87=9,94(g)\)

Đáp án A
Các phương trình phản ứng:
Nhiệt phân hỗn hợp X:
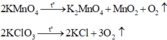
Chất rắn Y gồm K2MnO4, MnO2, KCl, KMnO4 dư. Rắn Y tác dụng với dung dịch HCl đặc:
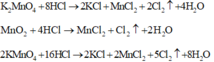
Tính toán:
Gọi số mol các chất trong hỗn hợp X là KMnO4: a mol ; KClO3: b mol. Ta có:
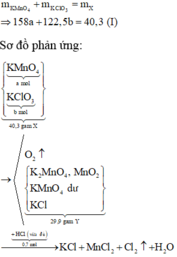
Bảo toàn khối lượng cho giai đoạn nhiệt phân X ta có:
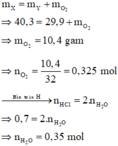
Theo sơ đồ thì cuối cùng O trong Y chuyển hết về H2O. Bảo toàn nguyên tố O cho giai đoạn nhiệt phân X ta có:

Xét giai đoạn nhiệt phân X:
Gọi x là số mol KMnO4 phản ứng
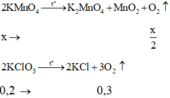
Hiệu suất nhiệt phân KMnO4 là:
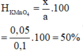
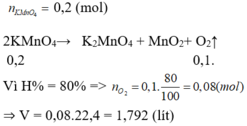


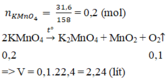
mO2 = 31,6 - 29,2 = 2,4 g
nO2 = 2,4/32 = 0,075 mol
2KMnO4 → K2MnO4 + MnO2 + O2
0,15 ← 0,075
mKMnO4 = 0,15.158 = 23,7 g
H = \(\dfrac{23,7}{31,6}\)= 75%
bn ơi cho mk hỏi là 158 là lấy ở đâu ạ