Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học:
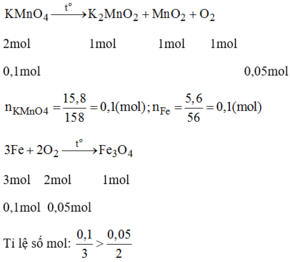
Vậy sắt còn dư nên khi đưa nam châm lại gần sản phẩm sau phản ứng thì nam châm bị hút.

Bài 1:
| Đơn chất | Hợp chất |
| S, O2 | NaCl, MgSO4, KCl, P2O5 |
Bài 2:
a) AgNO3
CTHH AgNO3 mang ý nghĩa:
- Là hợp chất tạo bởi 3 nguyên tố hóa học : Ag , N và O
- Tạo bởi 1 nguyên tử nguyên tố Ag, 1 nguyên tử nguyên tố N và 3 nguyên tử nguyên tố O.
- \(PTK_{AgNO_3}=NTK_{Ag}+NTK_N+3.NTK_O\\ =108+14+3.16=170\left(đ.v.C\right)\)
b) KHSO4
CTHH KHSO4 mang ý nghĩa:
- Là hợp chất cấu tạo từ 4 nguyên tố hóa học: K,H,S và O
- Cấu tạo bởi 1 nguyên tử nguyên tố K, 1 nguyên tử nguyên tố H, 1 nguyên tử nguyên tố A và 4 nguyên tử nguyên tố O.
- \(PTK_{KHSO_4}=NTK_K+NTK_H+NTK_S+4.NTK_O\\ =39+1+32+4.16=136\left(đ.v.C\right)\)
Bài tập 3:
a) Gọi CT ghi hóa trị của S(IV) và O là \(S_x^{IV}O_y^{II}\)(x,y : nguyên, dương)
Theo quy tắc hóa trị, ta có:
\(x.IV=y.II\\ =>\dfrac{x}{y}=\dfrac{II}{IV}=\dfrac{2}{4}=\dfrac{1}{2}\)
=> x=1; y=2
=> CTHH là SO2
b) Gọi CT ghi hóa trị của Al(III) và Cl(I) là \(Al_x^{III}Cl_y^I\) (x,y: nguyên, dương)
Theo quy tắc hóa trị ta có:
\(x.III=y.I\\ =>\dfrac{x}{y}=\dfrac{I}{III}=\dfrac{1}{3}\)
=> x=1; y=3
=> CTHH là AlCl3
Bài 4:
a) Gọi CT gọi hóa trị của hợp chất CuCl2 là \(Cu^aCl_2^b\)(a,b: nguyên, dương)
Theo Quy tắc hóa trị, ta có:
\(1.a=2.b\\ =>\dfrac{a}{b}=\dfrac{2}{1}=\dfrac{II}{I}\)
=> a= II, b=I
=> Trong hợp chất CuCl2 : Cu(II) và Cl(I)
b) Gọi CT kèm hóa trị của hợp chất Fe(NO3)2 là: \(Fe^a\left(NO_3\right)_2^b\) (a,b: nguyên, dương)
Theo quy tắc hóa trị, ta có:
\(1.a=2.b\\ =>\dfrac{a}{b}=\dfrac{2}{1}=\dfrac{II}{I}\\ =>a=II;b=I\)
=> Trong hợp chất Fe(NO3)2 : Fe(II) và nhóm nguyên tử NO3 (I)

PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
a. Theo PTHH: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}0,1=0,05\left(mol\right)\)
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=0,05.22,4=1,12\left(l\right)\)
b. PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Ta có: \(\dfrac{1}{n_{O_2}}=\dfrac{1}{0,05}\)
\(\dfrac{1}{n_{Fe}}=\dfrac{1}{0,1}\)
\(\Rightarrow\dfrac{1}{n_{O_2}}>\dfrac{1}{n_{Fe}}\)
Vậy Fe dư
Theo PTHH: \(n_{Fe_3O_4}=\dfrac{0,1.1}{3}=\dfrac{1}{30}\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=\dfrac{1}{30}.232\approx7,73g\)

PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
a, Ta có: \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{2}{3}n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
b, Theo PT: \(n_{Fe_3O_4}=\dfrac{1}{2}n_{O_2}=0,075\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,075.232=17,4\left(g\right)\)
c, PT: \(2KMnO_4\underrightarrow{t^o}KMnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
Bạn tham khảo nhé!

PTHH: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{3}< \dfrac{0,4}{2}\) \(\Rightarrow\) Oxi còn dư, Fe p/ứ hết
\(\Rightarrow n_{O_2\left(dư\right)}=0,4-\dfrac{2}{15}=\dfrac{4}{15}\left(mol\right)\)
+) Theo PTHH: \(\left\{{}\begin{matrix}n_{O_2}=\dfrac{2}{15}\left(mol\right)\\n_{Fe_3O_4}=\dfrac{1}{15}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{kk}=\dfrac{2}{15}\cdot22,4\cdot5\approx14,93\left(l\right)\\m_{Fe_3O_4}=\dfrac{1}{15}\cdot232\approx15,47\left(g\right)\end{matrix}\right.\)

a, Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{2}< \dfrac{0,2}{1}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,05\left(mol\right)\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
b, \(n_{H_2O}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{H_2O}=0,3.18=5,4\left(g\right)\)
c, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
_______0,3_______________________0,15 (mol)
\(\Rightarrow m_{KMnO_4}=0,3.158=47,4\left(g\right)\)
Bạn tham khảo nhé!

a, nZn = 13/65 = 0,2 (mol)
PTHH: 2Zn + O2 -> (t°) 2ZnO
Mol: 0,2 ---> 0,1 ---> 0,2
b, VO2 = 0,1 . 22,4 = 2,24 (l)
c, mZnO = 0,2 . 81 = 16,2 (g)
d, PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,1 . 2 = 0,2 (mol)
mKMnO4 = 0,2 . 158 = 31,6 (g)

PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
Ta có: \(n_{Fe}=\dfrac{0,84}{56}=0,015\left(mol\right)\) \(\Rightarrow n_{Fe_3O_4}=0,005\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,005\cdot232=1,16\left(g\right)\)
2KMnO4 \(\xrightarrow[]{t^o}\) K2MnO4 + MnO2 + O2(1)
3Fe + 2O2 \(\xrightarrow[]{t^o}\) Fe3O4(2)
nKMnO4 = 15,8 : 158 = 0,1 mol
nFe = 5,6 : 56 = 0,1 mol
Theo pt 1 nO2 = \(\dfrac{1}{2}nKMnO_4=0,05mol\)
Lập tỉ lệ phương trình (2)
nFe : nO2 = \(\dfrac{0,1}{3}:\dfrac{0,05}{2}\)
Do 0,1/3 > 0,05/2 => Fe dư
Vậy sản phẩm thu được có Fe dư => bị nam châm hút