Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có:
828,6 (lít) khí thiên nhiên có 0,85x (mol) CH4 và 0,1x (mol) C2H6
106 (l) (lít) khí thiên nhiên có a (mol) CH4 và b (mol) C2H6

Số mol vinyl clorua thực tế là:
(18973,2 + 4464,3).0,65 = 15234,4(mol)
Khối lượng vinyl clorua thực tế thu được là:
15234,4. 62,5 = 952,15.103 (g) = 952,15 (kg)

Nhiệt lượng cần để đun nóng 100 lít nước từ 20oC lên 100oC là:
4,18.(100 - 20).(100.103) = 33 440 000 (J) = 33 440 (kJ)
Gọi số mol khí thiên nhiên là x (mol)
⇒ nCH4 = 0,85x (mol) ; nC2H6 = 0,1x (mol)
Nhiệt lượng toả ra khi đốt cháy metan là: 880.0,85x = 748x (kJ)
Nhiệt lượng toả ra khi đốt cháy etan là: 15600.0,1x = 156x (kJ)
⇒ 748x + 156x = 33440
⇒ x = 36,991 (mol)
Vậy thể tích khí thiên nhiên cần dùng là:
36,991.22,4 = 828,6 (lít) (đktc)

Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
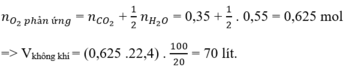

Đáp án A
n C O 2 = 7 , 84 22 , 4 = 0 , 35 ( m o l ) ; n H 2 O = 9 , 9 18 = 0 , 55 ( m o l )
Bảo toàn nguyên tố O:
2 n O 2 = 2 n C O 2 + n H 2 O ⇒ n O 2 = 0 , 625 ( m o l ) ⇒ V O 2 = 0 , 625 . 22 , 4 = 14 l
Vì oxi chiếm 1/5 Vkk => Vkk = 5.14 = 70 (lít)

Đáp án B
Ta có trong 10 lít khí thiên nhiên có 9,6 lít CH4; 0,2 lít N2 và 0,2 lít CO2.
Đốt cháy khí thiên nhiên có phản ứng hóa học sau:
CH4 + 2O2 → t o CO2 + 2H2O
Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol.
→ Cứ 9,6 lít CH4 phản ứng cần 9,6.2 = 19,2 lít O2.

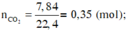
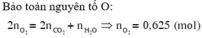
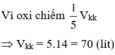
1. Trong 1000 m 3 khí thiên nhiên có 850 m 3 C H 4
2 C H 4 → 1500 ° C C 2 H 2 + 3 H 2
CH ≡ CH + HCl → 150 - 200 ° C , H g C l 2 C H 2 = C H - C l
Khối lượng vinyl clorua thu được (nếu hiệu suất các quá trình là 100%) là:
Với hiệu suất cho ở đầu bài, khối lượng vinyl clorua là:
2. Nhiệt lượng cần dùng để làm nóng 100 lít nước từ 20 ° C lên 100 ° C :
100.4,18.(100 - 20) = 33440 (kJ)
Vì 20% nhiệt lượng đã toả ra môi trường nên nhiệt lượng mà khí thiên nhiên cần cung cấp phải là :
Đặt số mol C 2 H 6 tà x thì số mol C H 4 là 85. 10 - 1 x.
Ta có 1560x + 88085. 10 - 1 x = 41800
x = 462. 10 - 2
Thể tích khí thiên nhiên cần dùng: