Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
n C O 2 = 7 , 84 22 , 4 = 0 , 35 ( m o l ) ; n H 2 O = 9 , 9 18 = 0 , 55 ( m o l )
Bảo toàn nguyên tố O:
2 n O 2 = 2 n C O 2 + n H 2 O ⇒ n O 2 = 0 , 625 ( m o l ) ⇒ V O 2 = 0 , 625 . 22 , 4 = 14 l
Vì oxi chiếm 1/5 Vkk => Vkk = 5.14 = 70 (lít)

Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
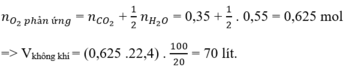

Đáp án B
Ta có trong 10 lít khí thiên nhiên có 9,6 lít CH4; 0,2 lít N2 và 0,2 lít CO2.
Đốt cháy khí thiên nhiên có phản ứng hóa học sau:
CH4 + 2O2 → t o CO2 + 2H2O
Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol.
→ Cứ 9,6 lít CH4 phản ứng cần 9,6.2 = 19,2 lít O2.

a, Ta có: \(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\Rightarrow n_H=0,6.2=1,2\left(mol\right)\)
m = mC + mH = 0,4.12 + 1,2.1 = 6 (g)
b, Theo ĐLBT KL, có: m + mO2 = mCO2 + mH2O
⇒ mO2 = 22,4 (g) \(\Rightarrow n_{O_2}=\dfrac{22,4}{32}=0,7\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,7.22,4=15,68\left(g\right)\)
\(\Rightarrow V_{kk}=\dfrac{15,68}{20\%}=78,4\left(g\right)\)

\(n_{CH_4}=a\left(mol\right),n_{CO}=b\left(mol\right)\).
\(a+b=0,1\)
Kết thúc phản ứng thu được \(CO_2\)và \(H_2O\).
\(n_{CO_2}=n_C=a+b\)
\(n_{H_2O}=\frac{1}{2}n_H=\frac{1}{2}.4a=2a\)
Ta có: \(44\left(a+b\right)+18.2a=6,2\)
Giải hệ thu được: \(a=b=0,05\).
\(\%V_{CH_4}=50\%\).

nC2H4 = 1.12/22.4 = 0.05 (mol)
CH2 = CH2 + Br2 => CH2Br - CH2Br
0.05.......................................0.05
mC2H4Br2 = 0.05*188 = 9.4 (g)
C2H4 + 3O2 -to-> 2CO2 + 2H2O
0.05.........0.15
Vkk = 5VO2 = 5*0.15*22.4 = 16.8 (l)
Cho hỏi ạ Br dư thì mình cần bằng la:
C2H2 + 2Br2--->C2H2Br4
0.05---------------------0.05
mC2H2Br4=0.05×346=17. 3 g
Đúng k

Đáp án A