Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi KL là R
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6(mol)\\ a,2R+6HCl\to 2RCl_3+3H_2\\ \Rightarrow n_R=0,4(mol)\\ \Rightarrow M_R=\dfrac{10,8}{0,4}=27(g/mol)(Al)\\ b,n_{HCl}=1,2(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1,2.36,5}{14,6\%}=300(g)\)

1/ PT : X + 2H2O -> X[OH]2 + H2
mol : \(\frac{6}{M_X}\) -> \(\frac{6}{M_X}\)
=> mH2 = \(\frac{12}{M_X}\) => mdd = m+6 - \(\frac{12}{M_X}\)
Ta có: m+5,7 = m+6 - \(\frac{12}{M_X}\)
<=> \(\frac{12}{M_X}\)= 0,3 => MX = 40 => X là Canxi [Ca]
2/ Dặt nHCl= a [a> 0] => mddHCl= 36,5a : 14,6 x 100= 250a
PT : X + 2HCL => XCl2 + H2
mol : a/2 a -> a/2 a/2
mH2 = a/2 x 2 = a ; mX = a/2 . MX
m XCl2= a/2 x [MX +71]
mdd XCL2= a/2 .MX + 250a - a = a/2 .MX +249a
Ta có :\(\frac{\frac{a}{2}\times M_X+\frac{71}{2}a}{M_X\times a:2+249a}\times100\%=24,15\%\)
<=> \(\frac{M_X+71}{M_X+498}=24,15\%\Leftrightarrow M_X=65\)=> X là kẽm [Zn]

CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)

Sửa đề cho kl có hoá trị 2
đầu tiên ta gọi kl dd là m(g) ta có nHCl=m*14.6/(100*36.5)= 0.004m mol.
M+2HCl=MCl2+H2
nM=nH2=nMuối= 1/2 nHCl=0.002m mol
khối lượng dung dịch sau phản ứng =0.002m*M +m-0.002m*2=0.002m*M+0.996m
ta có 0.002m*(M+71)/(0.002m*M+0.996m)=18.19%
(0.002M+0.142)/(0.002M+0.996)=0.1819
0.0016362M=0.0391724
M=24(Mg)
Xem lại đề nhé M hóa trị II thì ra Mg
\(2M+6HCl\rightarrow2MCl_3+3H_2\)
\(Gs:m_{dd\left(HCl\right)}=100\left(g\right)\)
\(n_{HCl}=\frac{100.14,6\%}{36,5}=0,4\left(mol\right)\)
\(\Rightarrow n_M=m_{MCl3}=\frac{2}{15}\left(mol\right)\)
\(n_{H2}=0,2\left(mol\right)\)
\(m_{dd\left(spu\right)}=\frac{2M_M}{15}+100-0,2.2=\frac{2M_M}{15}+99,6\left(g\right)\)
\(\frac{\frac{2}{15}.\left(M_M+35,5.3\right)}{\frac{2M_M}{15}+99,6\left(g\right)}=18,19\%\)
\(\Rightarrow M_M=35,91\)

nCO2 = 0,15 mol
MgCO3 + 2HCl ---> MgCl2 + CO2 + H2O
0.1 0,1 --> 0,1
RCO3 + 2HCl ---> RCl2 + CO2 + H2O
0,05 <---- (0,15-0,1)
Ta thấy: n HCl = 2n CO2 = 2.0,15 = 0,3 mol
m dd HCl = (0,3.36,5).100/7,3 = 150g
m CO2 = 0,15.44 = 6,6g
m dd sau phản ứng = m X + m dd HCl - m CO2 = 157,6 g
m MgCl2 = m dd sau phản ứng.C%/100 ~ 9,5g
n MgCl2 = 0,1 mol (thế vào pt trên)
Ta có: m RCO3 = m X - m MgCO3
=> 0,05(R + 60) = 14,2 - 0,1.84
=> R = 56
Vậy R là Fe
Chúc em học tốt!!

a)Giả sử có 1 mol MO phản ứng
\(MO+2HCl\rightarrow MCl_2+H_2O\)
1----------->2----------->1----------->1
=> \(m_{ddHCl}=\dfrac{2.36,5}{10\%}=730\left(g\right)\)
\(m_{ddsaupu}=\left(M+16\right)+730=M+746\left(g\right)\)
=> \(C\%_{MCl_2}=\dfrac{M+71}{M+746}.100=12,34\)
=> M=24 (Mg)
b) Giả sử có 1 mol M2On phản ứng
\(M_2O_n+2nHCl\rightarrow2MCl_n+nH_2O\)
1---------------->2n-------------->2----------->n
=> \(m_{ddHCl}=\dfrac{2n.36,5}{10\%}=730n\left(g\right)\)
\(m_{ddsaupu}=\left(2M+16n\right)+730n=2M+746n\left(g\right)\)
=> \(C\%_{MCl_2}=\dfrac{2\left(M+35,5n\right)}{2M+746n}.100=12,34\)
Chạy nghiệm n=1,2,3
n=1 => M=12 (loại)
n=2 => M=24 (Mg)
n=3 => M=36 (loại)

Chọn A

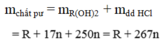
Vì phản ứng không sinh ra chất khí hay kết tủa
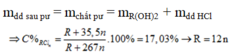
Vậy n = 2, R = 24 g/mol thỏa mãn, chất cần tìm là M g O H 2 .

\(n_{HCl}=\dfrac{200\cdot7.3\%}{36.5}=0.4\left(mol\right)\)
\(M+2HCl\rightarrow MCl_2+H_2\)
\(0.2.....0.4.........0.2........0.2\)
\(m_{MCl_2}=0.2\cdot\left(M+71\right)\left(g\right)\)
\(m_{dd}=0.2M+200-0.2\cdot2=0.2M+199.6\left(g\right)\)
\(C\%MCl_2=\dfrac{0.2\cdot\left(M+71\right)}{0.2M+199.6}\cdot100\%=12.05\%\)
\(\Rightarrow M=56\)
\(M:Sắt\)

PTHH: MCl2 + 2AgNO3 → M(NO3)2 + 2AgCl ↓
Theo pt: Số mol MCl2 = Số mol M(NO3)2
Mà: Khối lượng mol của MCl2 < Khối lượng mol của M(NO3)2 => Khối lượng muối M(NO3)2 hơn khối lượng muối ban đầu là 1,59(gam).
Khối lượng muối M(NO3)2 sau phản ứng là:
3,33 + 1,59 = 4,92 (gam)
Số mol MCl2 tính theo khối lượng là:
3,33 / MM + 71
Số mol M(NO3)2 tính theo khối lượng là:
4,92 / MM + 124
Mà: Số mol của 2 muối là bằng nhau
=> 3,33 / MM + 71 = 4,92 / MM + 124
=> MM = 40 ( Canxi )
=> Công thức hoá học của muối Clorua kim loại M là: CaCl2
Gọi CTHH của kim loại là A;
PTHH: A+ 2HCl--> ACl2 +H2;
giả sử nHCl= 2mol;
ta có : mmuối clorua /mdd=18,19%;
<--> (MA + 71)/ (MA+73/14,6% -2)=18,19%;
--> MA =24 --> A là Mg