Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

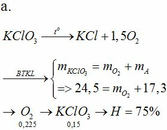
b.
4P + 5O2 → 2P2O5
0,16→ 0,2
Dư: 0,025
Sau pứ m(bình 1) = mP2O5 = 11,36 (g)
O2 + 2C → 2CO
0,025→ 0,05 0,05
Dư: 0,25
Sau pứ m(bình 2) = mCdư = 3 (g)

Sau phản ứng, thu được hỗn hợp kim loại, suy ra kẽm dư.
$n_{CuSO_4} = \dfrac{80.30\%}{160} = 0,15(mol)$
$Zn + CuSO_4 \to ZnSO_4 + Cu$
$n_{Zn\ pư} = n_{CuSO_4} = 0,15(mol)$
$\Rightarrow m_{Zn\ pư} = 0,15.65 = 9,75(gam)$
Sau phản ứng, $m_{dd} = 9,75 + 80 - 0,15.64 = 80,15(gam)$
$C\%_{ZnSO_4} = \dfrac{0,15.161}{80,15}.100\% = 30,13\%$

\(n_{CH_3COOC_2H_5}=\dfrac{4,4}{88}=0,05\left(mol\right)\)
PTHH: CH3COOH + C2H5OH --H2SO4(đ),to--> CH3COOC2H5 + H2O
0,05<--------------------------------------0,05
=> \(m_{CH_3COOH\left(lý.thuyết\right)}=0,05.60=3\left(g\right)\)
=> \(m_{CH_3COOH\left(tt\right)}=\dfrac{3.100}{60}=5\left(g\right)\)

\(Fe+S-t^0->FeS\\ n_{Fe}:n_S=\dfrac{11,2}{56}:\dfrac{4,8}{32}=0,2:0,15\Rightarrow Fe:dư\left(0,05mol\right)\\ Fe+2HCl->FeCl_2+H_2\\ FeS+2HCl->FeCl_2+H_2S\\ d_{\dfrac{B}{kk}}=\dfrac{\dfrac{0,05.2+0,15.34}{0,2}}{29}=0,89655\)

mCuSO4 = 80.30% = 24 gam ==> nCuSO4 = 0,15 mol
dung dịch có 80-24 = 56 gam H2O
Zn + CuSO4 → ZnSO4 + Cu
Sau phản ứng thu được 16,1 hỗn hợp kim loại nên sau phản ứng phải có Zn dư và CuSO4 phản ứng hết.
nZn phản ứng = nCuSO4 = 0,15 ==> mZn = 0,15.65=9,75 gam
Chất tan trong dung dịch thu được là ZnSO4 = 0,15mol
mZnSO4 = 0,15.161= 24,15 gam
m dung dịch sau phản ứng = mH2O + mZnSO4 = 80,15 gam
C%ZnSO4 = \(\dfrac{24,15}{24,15+56}.100\)= 30,13%
b.
Hỗn hợp kim loại A gồm Zn dư và Cu : 0,15 mol
=> mZn = 16,1 - 0,15.64= 6,5 gam <=> nZn = 0,1 mol
Cho A tác dụng với HCl chỉ có Zn phản ứng
Zn + 2HCl --> ZnCl2 + H2
0,1 --------------> 0,1
==> VH2 = 0,1 .22,4 = 2,24 lít

Gọi số mol KMnO4 và KClO3 trong hỗn hợp ban đầu lần lượt là x,y
158x + 122,5y= 48,2 (1)
Bảo toàn elcton toàn quá trình ta có
Mn+7+5e →Mn+2
x 5x
Cl+5 + 6e → Cl–1
y 6y
(về bản chất có 1 phần Cl+5 có 1 phần chuyển sang Cl0, nhưng Cl–1 lại nhường e tạo Cl0 vì vậy để đơn giản ta có thể coi tất cả Cl+5 tạo thành Cl–1)
2Cl–1→ Cl2 +2e
0,675 0,135
2O–2 → O2 + 4e
0,15 0,6
Áp dụng định luật bảo toàn e ta có 5x+6y=1,95 (2)
Từ 1 và 2 ta có hệ phương trình
Giải ta được x=0,15 và y=0,2
% mKMnO4 = 49,17 % và % mKClO3 =50,83%
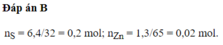

ghi có thiếu gì không bạn?