Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nBr2 = 0,125 mol
Khi đốt cháy nA = 0,25 mol
mNaOH ban đầu = 36g => nNaOH = 0,9 mol
Gọi x, y lần lượt là số mol của CO2 và H2O
mdd = 180 + 44x + 18y
Vì NaOH dư do đó chỉ tạo muối trung hòa
CO2 +2NaOH → Na2CO3 + H2O
x 2x
nNaOH dư = 0,9 – 2x
có 2 , 75 % = 40 ( 0 , 9 - 2 x ) 180 + 44 x + 18 y . 100 % (1)
=> 81,21x + 0,495y = 31,05n
2,8 lít khí A tác dụng với 0,125 mol Br2
=> 5,6 lít khí A tác dụng với 0,25 mol Br2
Gọi số mol khí của CH4, C2H4 và C2H2 lần lượt là a; b; c
Ta có a + b + c = 0,25 mol
Và b + 2c = 0,25
=> a = c
=> khi đốt cháy hỗn hợp A cho nCO2 = nH2O
Thay vào (1) => x = y = 0,38 mol
Bảo toàn C, H khi đốt cháy ta có
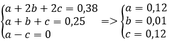
=> %VCH4 = %VC2H2 = 48%
%VC2H4 = 4%

A. Có chất rắn màu đỏ bám ngoài đinh sắt, màu xanh dung dịch nhạt dần.

Câu 4: Cho một mẩu nhôm vào ống nghiệm chứa dung dịch NaOH dư hiện tượng xuất hiện là:
A.Có khí không màu thoát ra, nhôm tan dần tạo thành dung dịch trong suốt
B.Có khí màu vàng lục thoát ra, nhôm tan dần tạo thành dung dịch trong suốt
C.Có khí không màu thoát ra, nhôm tan dần tạo thành dung dịch màu xanh
D.Không có khí thoát ra, nhôm tan dần tạo thành dung dịch trong suốt

a, Ta có: \(n_{CH_4}+n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
\(16n_{CH_4}+28n_{C_2H_4}=3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,1\left(mol\right)\\n_{C_2H_4}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%\approx53,33\%\\\%m_{C_2H_4}\approx46,67\%\end{matrix}\right.\)
- Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%\approx66,67\%\\\%V_{C_2H_4}\approx33,33\%\end{matrix}\right.\)
b, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Có: m tăng = mC2H4 = 0,05.28 = 1,4 (g)
a) \(n_{hh}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,15\\16a+28b=3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%=53,33\%\\\%m_{C_2H_4}=100\%-53,33\%=46,67\%\end{matrix}\right.\)
b) \(m=m_{C_2H_4}=0,05.28=1,4\left(g\right)\)

\(n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{Br_2}=0,4.0,5=0,2\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,2}{1}\), ta được Br2 dư.
→ Dd Brom nhạt màu dần.

B5:
1)
\(V_{thoát}=V_{CH_4\left(đktc\right)}=3,36\left(l\right)\\ \Rightarrow\%V_{\dfrac{CH_4}{B}}=\dfrac{3,36}{4,48}.100=75\%\Rightarrow\%V_{\dfrac{C_2H_4}{B}}=100\%-75\%=25\%\)
2)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\\ n_{CH_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ \Rightarrow n_{CaCO_3}=n_{CO_2}=n_{CH_4}=0,15\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{CaCO_3}=100.0,15=15\left(g\right)\)

Nhỏ một giọt phenolphtalein vào dung dịch KOH, dung dịch có màu đỏ, nhỏ từ từ dung dịch HCl cho tới dư vào dung dịch có màu đỏ trên thì
1.màu đỏ nhạt dần, mất hẳn rồi chuyển sang màu xanh.
2.màu đỏ đậm thêm dần.
3.màu đỏ vẫn không thay đổi.
4.màu đỏ nhạt dần rồi mất hẳn.
Do HCl (dư) tác dụng với KOH sẽ tạo thành muối và axit dư, muối và axit không làm đổi màu dung dịch phenolphtalein
\(HCl+KOH\rightarrow KCl+H_2O\)
Màu vàng của dung dịch brom nhạt hơn lúc đầu.
Màu vàng của dung dịch brom nhạt hơn lúc đầu