Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi a là số mol của lá nhôm tham gia p/ứ:
PTHH:
2Al + 3 CuSO4 \(\rightarrow\)Al(SO4)3 + 3 Cu
a mol\(\rightarrow\)\(\frac{3}{2}\)a mol \(\rightarrow\) \(\frac{3}{2}\)a mol
Theo đề bài cho độ tăng KL của lá nhôm sau p/ứ là:
mCu bám - mal tan = \(\frac{3}{2}\)62a - 27a= 1,38
\(\Rightarrow\)a= 0,02 mol
a) Khối lượng nhôm tham gia phản ứng:
m= n x M = 0,02 x 27 = 0,54 g
b) Khối lượng đồng sunfat trong dung dịch
m = n x M = \(\frac{3}{2}\)0,02 x 160= 4,8 g

- Lớp cặn này là do calcium bicarbonate hoặc magnesium bicarbonate tan trong nước, nhờ nhiệt độ sinh ra calcium carbonate hoặc magnesium hydroxide lắng xuống đáy cùng một số tạp chất.
- Phương pháp loại bỏ lớp cặn ở đáy ấm:
+ Giấm hoặc chanh: thành phần chủ yếu của cặn nước là calcium carbonate, sẽ phản ứng với axetic acid trong giấm, tạo thành các chất khoáng tan được trong nước và khí CO2. Đổ giấm 10% vào trong ấm đun nước, sau đó thêm nước, đun sôi để nguội 1 tiếng, sau đó rửa lại là ấm lại sáng bóng như mới.
+ Baking soda: Hầu hết các ấm đun nước đều làm bằng nhôm, vì vậy, có thể bỏ một thìa nhỏ baking soda vào, đun sôi lên vài phút là cặn có thể được loại bỏ. Hoặc cũng có thể đổ baking soda có độ đặc 1%, thêm 500ml nước, lau nhẹ đáy ấm là sạch.
Lớp cặn này là do calcium bicarbonate hoặc magnesium bicarbonate tan trong nước, nhờ nhiệt độ sinh ra calcium carbonate hoặc magnesium hydroxide lắng xuống đáy cùng một số tạp chất.
+ Khoai sọ: Khi mới mua ấm siêu tốc về, nên cho vỏ khoai sọ vào ấm, thêm đầy nước và nấu khoảng 30 phút. Làm như vậy, sau này khi đun nước sẽ không còn bị cặn nữa. Đối với ấm siêu tốc cũ đã tích cặn thì cũng có thể áp dụng cách này để lấy đi lớp cặn trong ấm.
Giấm hoặc chanh: Đây là cách đơn giản và hiệu quả nhất. Mọi người đều biết thành phần chủ yếu của cặn nước là calcium carbonate, sẽ phản ứng với axetic acid trong giấm, tạo thành các chất khoáng tan được trong nước và khí CO2. Đổ giấm 10% vào trong ấm đun nước, sau đó thêm nước, đun sôi để nguội 1 tiếng, sau đó rửa lại là ấm lại sáng bóng như mới....

a. PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b. Có \(n_{Mg}=\frac{3,6}{24}=0,15mol\)
\(140ml=0,14l\)
\(n_{H_2SO_4}=0,14.1,2=0,168mol\)
Lập tỉ lệ \(\frac{n_{Mg}}{1}< \frac{n_{H_2SO_4}}{1}\)
Vậy Mg đủ, \(H_2SO_4\) dư
Theo phương trình \(n_{H_2SO_4}=n_{Mg}=0,15mol\)
\(\rightarrow n_{H_2SO_4\left(\text{(dư)}\right)}=0,168-0,15=0,018mol\)
\(\rightarrow m_{H_2SO_4\left(\text{(dư)}\right)}n.M=0,018.98=1,764g\)
c. MgSO\(_4\) là muối
Theo phương trình \(n_{MgSO_4}=n_{Mg}=0,15mol\)
\(\rightarrow m_{\text{muối}}=m_{MgSO_4}=n.M=0,15.120=18g\)
d. \(H_2\) là khí
Theo phương trình \(n_{H_2}=n_{Mg}=0,15mol\)
\(\rightarrow V_{H_2\left(ĐKTC\right)}=n.22,4=0,15.22,4=3,36l\)

a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32 gam oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4 gam chất rắn. Biết khối lượng mol phân tử của oxit sắt là 160 gam/mol.
b) Chất khí sinh ra được hấp thụ hoàn toàn bằng nước vôi trong dư. Tính khối lượng kết tủa thu được.
Giải
a) Gọi CTHH của oxit sắt là: FexOy
PTHH: : FexOy + yCO ------> xFe + yCO2
Số mol Fe là

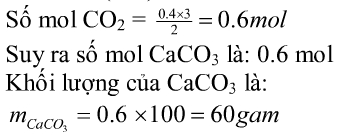
a/
mFe=22,4g
=> mO = 32-22,4=9,6g
Gọi công thức oxit sắt: FexOy
x:y=(22,4:56):(9,6:16)=2:3
=> CT: Fe2O3.
b/
nO=nC=nCO2=(9,6:16)=0,6mol
nCaCO3 =nCO2=0,6mol
=> mCaCO3 =0,6.100=60g

Số hiệu là 11
Cấu tạo nguyên tử: Na
Tính chất hóa học đặc trưng là kim loại hoạt động mạnh
Tính chất hóa học của A mạnh hơn Mg, Al
ài 4. Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng tuần hoàn các nguyên tố hoá học. Hãy cho biết:
- Cấu tạo nguyên tử của A.
- Tính chất hoá học đặc trưng của A.
- So sánh tính chất hoá học của A với các nguyên tố lân cận.
giải
Số hiệu là 11
Cấu tạo nguyên tử: Na
Tính chất hóa học đặc trưng là kim loại hoạt động mạnh
Tính chất hóa học của A mạnh hơn Mg, Al

nA = = 0,015625 mol.
MA = = 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x = 32g => nO =
= 2 mol
mS = 64 - 32 = 32g => ns = = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
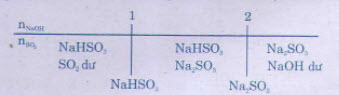
b) Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:
Bài 7*. a) Hãy xác định công thức của hợp chất khí A, biết rằng :
- A là oxit của lưu huỳnh chứa 50% oxi.
- 1 gam khí A chiếm thề tích là 0,35 lít ở đktc.
b) Hoà tan 12,8 gam hợp chất khí A vào 300 ml dung dịch NaOH 1,2M. Hãy cho biết muối nào thu được sau phản ứng. Tính nồng độ mol của muối (giả thiết thể tích dung dịch thay đổi không đáng kể).
Lời giải:
nA = = 0,015625 mol.
MA = = 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x = 32g => nO =
= 2 mol
mS = 64 - 32 = 32g => ns = = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
b) * Hướng dẫn: Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:


Thành phần chính của thuốc muối là natri hiđrôcacbonat, CTHH: NaHCO3. Trong dạ dày thường chứa dung dịch axit. Người bị đau dạ dày là người có nồng độ dung dịch axit HCl cao làm dạ dày bị bào mòn. NaHCO3 dùng để làm thuốc trị đau dạ dày vì nó làm giảm hàm lượng dung dịch HCl có trong dạ dày nhờ có phản ứng hóa học.
NaHCO3 + HCl → NaCl + CO2 + H2O
Thành phần chính của thuốc muối nabica là natri hidrocacbonat (NaHCO3).
Cơ chế hoạt động của thuốc: Trong dạ dày có 1 lượng axit HCl giúp hòa tan các loại muối khó tan trong quá trình ăn uống. Khi axit dạ dày tăng cao, nếu uống thuốc muối nabica thì NaHCO3 trong thuốc muối tác dụng với axit HCl trong dạ dày theo phương trình hóa học:
NaHCO3 + HCl \(\rightarrow\) NaCl + CO2\(\uparrow\) + H2O.
Lượng axit thừa trong dạ dày đã tác dụng với NaHCO3 có trong thuốc muối nabica, do vậy không còn, nhờ vậy người bị ợ chua, thừa axit không còn bị như vậy nữa.
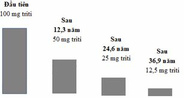


Chu kì phân rã của triti là 12,3 năm. Tức sau 12,3 năm thì một nửa lượng triti bị phân rã
=> Sau 61,5 năm = 5 chu kì bán rã
=> sau 61,5 năm thì lượng triti còn lại là 3,125 mg
Vậy sau 61,5 năm lượng triti còn lại là 3,125 mg.