Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nA=0.015625
=> A =64
A SOx =64 => x=2
=> SO2
nNaOH= 0.36
nSO2=0.2
nNaOH/nSO2=1.8
=> Tạo 2 muối Na2SO3 và NaHSO3
NaOH + SO2 -----> NaHSO3
x-------------x-----------------x
2NaOH + SO2 -----> Na2SO3 + H2O
2y------------y----------------y
x+y=0.2
x+2y=0.36
=> x=0.04,y=0.16
CM NaHSO3 =0.04/0.3=2/15M
CM Na2SO3 = 8/15M
xĐặt công thức tổng quát SxOy
nA = \(\dfrac{0,35}{22,4}\)= 0,015625 ( mol )
⇒ MA = \(\dfrac{1}{0,015625}\) = 64 (gam/mol)
⇒ MO = \(\dfrac{64.50}{32}\)= 32 ( gam/mol)
⇒ MS = 64-32 = 32 ( gam/mol)
⇒ x = \(\dfrac{32}{32}\)= 1
⇒ y = \(\dfrac{32}{16}\)= 2
⇒ CTHH: SO2
nSO2 = \(\dfrac{12,8}{64}\)= 0,2 ( mol )
nNaOH = 0,3.1,2 = 0,36 ( mol )
\(\dfrac{n_{CO2}}{n_{NaOH}}\)= \(\dfrac{0,36}{0,2}\)= 1,8
⇒ Tạo hai muối
SO2 + 2NaOH → Na2SO3 + H2O (1)
x........2x.................x...............x
SO2 + NaOH → NaHSO3 (2)
y............y................y
Từ (1) và (2) ta có hệ phương trình\(\left\{{}\begin{matrix}x+y=0,2\\2x+y=0,36\end{matrix}\right.\)
⇒ x = 0,16 ; y = 0,36
⇒ CM Na2SO3 = \(\dfrac{0,16}{0,3}\)= 0,53(M)
⇒ CM NaHSO3= \(\dfrac{0,02}{0,3}\)= 0,067(M)

nFe = 0,1 mol; nS = 0,05 mol
a) Phương trình phản ứng:
Fe + S → FeS (1)
nFe dư = 0,1 – 0,05 = 0,05 nên hỗn hợp chất rắn A có Fe và FeS.
Fe + 2HCl → FeCl2 + H2↑ (2)
FeS + 2HCl → FeCl2 + H2S↑ (3)
b) Dựa vào phương trình phản ứng (2) và (3), ta có:
nHCl= 0,1 + 0,1 = 0,2 mol
VHCl = 0,2 /1 = 0,2 lít.

a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32 gam oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4 gam chất rắn. Biết khối lượng mol phân tử của oxit sắt là 160 gam/mol.
b) Chất khí sinh ra được hấp thụ hoàn toàn bằng nước vôi trong dư. Tính khối lượng kết tủa thu được.
Giải
a) Gọi CTHH của oxit sắt là: FexOy
PTHH: : FexOy + yCO ------> xFe + yCO2
Số mol Fe là

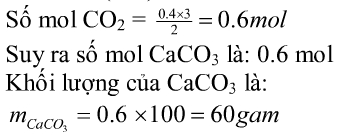
a/
mFe=22,4g
=> mO = 32-22,4=9,6g
Gọi công thức oxit sắt: FexOy
x:y=(22,4:56):(9,6:16)=2:3
=> CT: Fe2O3.
b/
nO=nC=nCO2=(9,6:16)=0,6mol
nCaCO3 =nCO2=0,6mol
=> mCaCO3 =0,6.100=60g

a. PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b. Có \(n_{Mg}=\frac{3,6}{24}=0,15mol\)
\(140ml=0,14l\)
\(n_{H_2SO_4}=0,14.1,2=0,168mol\)
Lập tỉ lệ \(\frac{n_{Mg}}{1}< \frac{n_{H_2SO_4}}{1}\)
Vậy Mg đủ, \(H_2SO_4\) dư
Theo phương trình \(n_{H_2SO_4}=n_{Mg}=0,15mol\)
\(\rightarrow n_{H_2SO_4\left(\text{(dư)}\right)}=0,168-0,15=0,018mol\)
\(\rightarrow m_{H_2SO_4\left(\text{(dư)}\right)}n.M=0,018.98=1,764g\)
c. MgSO\(_4\) là muối
Theo phương trình \(n_{MgSO_4}=n_{Mg}=0,15mol\)
\(\rightarrow m_{\text{muối}}=m_{MgSO_4}=n.M=0,15.120=18g\)
d. \(H_2\) là khí
Theo phương trình \(n_{H_2}=n_{Mg}=0,15mol\)
\(\rightarrow V_{H_2\left(ĐKTC\right)}=n.22,4=0,15.22,4=3,36l\)

Đối với chất khí, khi đo cùng diều kiện về nhiệt độ, áp suất thì trong phương trình hóa học, tỉ lệ vế số mol cũng là tỉ lệ về thể tích khí.
Khi dẫn hỗn hợp {CO, C02} qua nước vôi trong dư, toàn bộ CO2 bị hấp thụ hết do phản ứng với Ca(OH)2. Khí A là khí CO.
Phương trình hóa hóa học khi đốt khí CO:
O2 + 2CO 2CO2
p.ư: 2 → 4 lit
Trong 16 lít hỗn hợp {CO, C02} có 4 lít khí co và 16 - 4 = 12 lít khí CO2.
%VCO = 100% = 25%; % = 100% - 25% = 75%
Bài 5. Hãy xác định thành phần % về thể tích của mỗi khí trong hỗn hợp CO và CO2, biết các số liệu thực nghiệm sau :
a) Dần 16 lít hỗn hợp CO và CO2 qua nước vôi trong dư thu được khí A.
b) Để đốt cháy hoàn toàn khí A cần 2 lít khí oxi.
Các thể tích khí được đo ở cùng điểu kiện nhiệt độ và áp suất.
Lời giải:
Đối với chất khí, khi đo cùng diều kiện về nhiệt độ, áp suất thì trong phương trình hóa học, tỉ lệ vế số mol cũng là tỉ lệ về thể tích khí.
Khi dẫn hỗn hợp {CO, C02} qua nước vôi trong dư, toàn bộ CO2 bị hấp thụ hết do phản ứng với Ca(OH)2. Khí A là khí CO.
Phương trình hóa hóa học khi đốt khí CO:
O2 + 2CO 2CO2
p.ư: 2 → 4 lit
Trong 16 lít hỗn hợp {CO, C02} có 4 lít khí co và 16 - 4 = 12 lít khí CO2.
%VCO = 100% = 25%; % = 100% - 25% = 75%

Số mol Cl2 = 1,12 : 22,4 = 0,05 mol
Phương trình hóa học:
Cl2 + 2NaOH -> NaCl + NaClO + H2O.
Phản ứng: 0,05 0,1 0,05 0,05
Dung dịch sau phản ứng có 2 chất tan là NaCl và NaClO đều có 0,05 mol; Vdd = 0,1 lít.
CM(NaCl) = CM(NaClO) = = 0,5 M
Theo đề ta có PTHH:
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
theo pt:2(mol)__________________________>: 1(mol)
Theo đề, \(n_{Cl_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo pt: \(n_{NaOH}=2n_{Cl_2}=2.0,05=0,1\left(mol\right)\)
\(\Rightarrow V_{NaOH}=0,1.1=0,1\left(M\right)\)
Có 2 chất sau phản ứng là NaCl và NaClO.
theo pt, \(n_{NaCl}=n_{Cl_2}=0,05\left(mol\right);n_{NaClO}=n_{NaCl}=0,05\left(mol\right)\)
\(\Rightarrow C_{MNaCl}=C_{MNaClO}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)

a) Sơ đồ phản ứng:
S → SO2 → SO3 → H2SO4 → Na2SO4 → BaSO4.
b) Phương trình phản ứng:

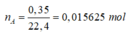
M A = m A n A = 1 0,015625 = 64 g / m o l
- Tìm số mol nguyên tử S, O trong phân tử A
Cứ 1 mol phân tử A có:
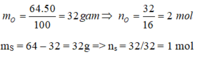
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO 2
Đáp án: C
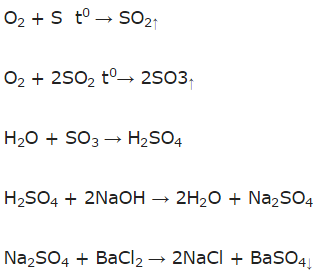
nA =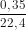 = 0,015625 mol.
= 0,015625 mol.
MA =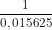 = 64g
= 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x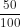 = 32g => nO =
= 32g => nO = 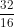 = 2 mol
= 2 mol
mS = 64 - 32 = 32g => ns =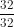 = 1 mol
= 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
b) Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:
Bài 7*. a) Hãy xác định công thức của hợp chất khí A, biết rằng :
- A là oxit của lưu huỳnh chứa 50% oxi.
- 1 gam khí A chiếm thề tích là 0,35 lít ở đktc.
b) Hoà tan 12,8 gam hợp chất khí A vào 300 ml dung dịch NaOH 1,2M. Hãy cho biết muối nào thu được sau phản ứng. Tính nồng độ mol của muối (giả thiết thể tích dung dịch thay đổi không đáng kể).
Lời giải:
nA =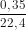 = 0,015625 mol.
= 0,015625 mol.
MA =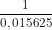 = 64g
= 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x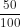 = 32g => nO =
= 32g => nO = 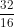 = 2 mol
= 2 mol
mS = 64 - 32 = 32g => ns =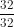 = 1 mol
= 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
b) * Hướng dẫn: Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối: