Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4 => Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)
Đáp án A

Đáp án A
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4 => Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)

Đáp án A
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4
=> Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)

\(n_{H_2}=0,015\left(mol\right)\)
\(n_{H_2SO_4}=0,0152\left(mol\right)\)
\(n_{CuSO_4}=0,0152\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}-->BaSO_4\)
\(Cu^{2+}+2OH^--->Cu\left(OH\right)_2\)
a) Do 2 kim loại có cùng số mol \(\Rightarrow\) đặt \(n_{Na}=n_{Ba}=a\left(mol\right)\)
BT e : \(n_{Na}+2n_{Ba}=2n_{H_2}\Leftrightarrow a+2a=0,15.2\Rightarrow a=0,1\left(mol\right)\)
\(n_{Na^+}=n_{Na}=0,1\left(mol\right);n_{Ba^{2+}}=n_{Ba}=0,1\left(mol\right)\)
\(\Sigma n_{SO_4^{2-}}=n_{H_2SO_4}+n_{CuSO_4}=0,0152+0,0152=0,0304\left(mol\right)\)
\(\Rightarrow SO_4^{2-}pư\) hết \(\Rightarrow n_{BaSO_4}=0,0304.233=7,0832\left(g\right)\)
\(\Sigma n_{OH^-}=n_{Na^+}+2n_{Ba^{2+}}=0,1+0,1.2=0,3\left(mol\right)\)
\(n_{OH\left(Cu\left(OH\right)_2\right)}=n_{OH^-Bđ}-n_{Ba^{2+}dư}-n_{Na^+}=0,3-\left(0,1-0,0304\right)-0,1=0,1304\left(mol\right)\)

Đáp án D
Gọi số mol Fe, Fe3O4, FeCO3 lần lượt là 8x, x, 2x mol
Số mol của Cu là:
0 , 2 . 8 x . 56 + 232 x + 116 . 2 x 64 = 2 , 85 x m o l
Dung dịch Y chứa 2 muối là FeSO4 và Fe2(SO4)3
Có nCO2 = nFeCO3 = 2x mol → nSO2 = 0,1185 - 2x mol
Bảo toàn electron cho toàn bộ quá trình → 2nFe + 2nCu = 2nFe3O4 +2 nSO2
→ 2. 8x + 2. 2,85x = 2. x + 2. ( 0,1185-2x) → x = 0,01
Hấp thụ khí vào dung dịch Ca(OH)2 thu được ↓ chứa
C a C O 3 : 0 , 01 . 2 = 0 , 02 m o l C a S O 3 : 0 , 1185 = 2 . 0 , 01 = 0 , 0985 m o l
→ m = 0,02. 100 + 0,0985.120 = 13,82 gam

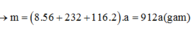
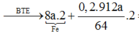
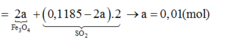


\(\left\{{}\begin{matrix}n_K=a\left(mol\right)\\n_{Ba}=b\left(mol\right)\end{matrix}\right.\)
\(n_{khí}=\dfrac{0,448}{22,4}=0,02mol\)
\(2K+2H_2O\rightarrow2KOH+H_2\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
Từ hai pt:\(\Rightarrow\left\{{}\begin{matrix}\dfrac{a}{b}=\dfrac{1}{2}\\\dfrac{a}{2}+b=0,02\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,008\\b=0,016\end{matrix}\right.\)
\(\left\{{}\begin{matrix}n_{H_2SO_4}=0,05\cdot0,1=0,005\\n_{CuSO_4}=0,2\cdot0,1=0,02\end{matrix}\right.\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
0,008 0,004
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
0,016 0,016 0,016
\(2KOH+CuSO_4\rightarrow K_2SO_4+Cu\left(OH\right)_2\downarrow\)
0,008 0,008
\(Ba\left(OH\right)_2+CuSO_4\rightarrow Cu\left(OH\right)_2\downarrow+BaSO_4\downarrow\)
0,016 0,016 0,016
\(m_{\downarrow}=0,016\cdot233+0,008\cdot160+0,016\cdot160+0,016\cdot233=11,296g\)