Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4 => Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)
Đáp án A

Đáp án A
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4 => Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)

Đáp án A
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4
=> Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)

\(\left\{{}\begin{matrix}n_K=a\left(mol\right)\\n_{Ba}=b\left(mol\right)\end{matrix}\right.\)
\(n_{khí}=\dfrac{0,448}{22,4}=0,02mol\)
\(2K+2H_2O\rightarrow2KOH+H_2\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
Từ hai pt:\(\Rightarrow\left\{{}\begin{matrix}\dfrac{a}{b}=\dfrac{1}{2}\\\dfrac{a}{2}+b=0,02\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,008\\b=0,016\end{matrix}\right.\)
\(\left\{{}\begin{matrix}n_{H_2SO_4}=0,05\cdot0,1=0,005\\n_{CuSO_4}=0,2\cdot0,1=0,02\end{matrix}\right.\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
0,008 0,004
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
0,016 0,016 0,016
\(2KOH+CuSO_4\rightarrow K_2SO_4+Cu\left(OH\right)_2\downarrow\)
0,008 0,008
\(Ba\left(OH\right)_2+CuSO_4\rightarrow Cu\left(OH\right)_2\downarrow+BaSO_4\downarrow\)
0,016 0,016 0,016
\(m_{\downarrow}=0,016\cdot233+0,008\cdot160+0,016\cdot160+0,016\cdot233=11,296g\)

Đáp án D
![]() với số mol a và b
với số mol a và b ![]()
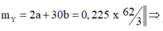
giải hệ có: a = 0,075 mol; b = 0,15 mol
![]()
![]()
Bảo toàn nguyên tố Nitơ: ![]()
Bảo toàn nguyên tố Fe: ![]()
Bảo toàn điện tích + nguyên tố Al: ![]()
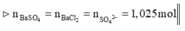
Thêm A g N O 3 dư => 2,05 mol AgCl và 0,4 mol Ag
![]()
![]()

Đáp án B
Đặt nBa = a, nBaO = 2a và nBa(OH)2 = 3a
⇒ nH2 = nBa = a ⇒ ∑nBa(OH)2 = a + 2a 3a = 6a = 6V/22.4
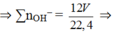
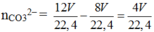
⇒ nBaCO3 = (4V/22,4) × 197 = 98,5 Û V = 2,8.
⇒ nBa = 2,8/22,4 = 0,125 mol ⇒ nBaO = 0,25, nBa(OH)2 = 0,375.
⇒ m = 0,125×137 + 0,25×153 + 0,375×171 = 119,5 gam

Đáp án B
Đặt nBa = a, nBaO = 2a và nBa(OH)2 = 3a
⇒ nH2 = nBa = a ⇒ ∑nBa(OH)2 = a + 2a 3a = 6a = 6 V 22 , 4
⇒ ∑nOH– = 12 V 22 , 4 ⇒ nCO32– = 12 V 22 , 4 - 8 V 22 , 4 = 4 V 22 , 4 .
⇒ nBaCO3 = 4 V 22 , 4 × 197 = 98,5 ⇔ V = 2,8.
⇒ nBa = 2 , 8 22 , 4 = 0,125 mol ⇒ nBaO = 0,25, nBa(OH)2 = 0,375.
⇒ m = 0,125×137 + 0,25×153 + 0,375×171 = 119,5 gam
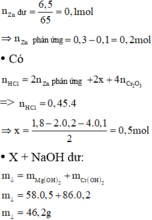
\(n_{H_2}=0,015\left(mol\right)\)
\(n_{H_2SO_4}=0,0152\left(mol\right)\)
\(n_{CuSO_4}=0,0152\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}-->BaSO_4\)
\(Cu^{2+}+2OH^--->Cu\left(OH\right)_2\)
a) Do 2 kim loại có cùng số mol \(\Rightarrow\) đặt \(n_{Na}=n_{Ba}=a\left(mol\right)\)
BT e : \(n_{Na}+2n_{Ba}=2n_{H_2}\Leftrightarrow a+2a=0,15.2\Rightarrow a=0,1\left(mol\right)\)
\(n_{Na^+}=n_{Na}=0,1\left(mol\right);n_{Ba^{2+}}=n_{Ba}=0,1\left(mol\right)\)
\(\Sigma n_{SO_4^{2-}}=n_{H_2SO_4}+n_{CuSO_4}=0,0152+0,0152=0,0304\left(mol\right)\)
\(\Rightarrow SO_4^{2-}pư\) hết \(\Rightarrow n_{BaSO_4}=0,0304.233=7,0832\left(g\right)\)
\(\Sigma n_{OH^-}=n_{Na^+}+2n_{Ba^{2+}}=0,1+0,1.2=0,3\left(mol\right)\)
\(n_{OH\left(Cu\left(OH\right)_2\right)}=n_{OH^-Bđ}-n_{Ba^{2+}dư}-n_{Na^+}=0,3-\left(0,1-0,0304\right)-0,1=0,1304\left(mol\right)\)
\(n_{Cu\left(OH\right)_2}=\dfrac{0,1304}{2}=0,0652\left(mol\right)\Rightarrow m_{Cu\left(OH\right)_2}=0,0652.98=6,3896\left(g\right)\)
\(\Rightarrow m=m_{BaSO_4}+m_{Cu\left(OH\right)_2}\)