Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Zn+ 2HCl --> ZnCl2 + H2
b, Tỉ lệ nguyên tử Zn : phân tử HCl : phân tử ZnCl2 : phân tử H2 là 1:2:1:1
c, Áp dụng ĐLBT khối lượng => mHCl phản ứng = mZnCl2 + mH2 -mZn
nH2 =22,4 /22,4 = 1 mol => mH2 = 2 gam
=> mZnCl2 = 136 + 2 - 65 = 73 gam

a) Zn + HCl -> ZnCl 2 + H2
Zn + 2HCl -> ZnCl2 + H2
1 : 2 : 1 : 1
c) mZn + MHCl = mZnCl + mH
130 + mHCl =2,72 +4
mHCl =(2,72+4) - 130
Còn lại bạn tự tính nhé !
a) Zn + HCl ----> ZnCl2 + H2
Zn + 2HCl -> ZnCl2 + H2
b) Zn + 2HCl -> ZnCl2 +H2
1ntử : 2 ptử : 1 ptử : 1 ptử
c) Áp dụng ĐLBTKL, ta có:
mZn + mHCl = mZnCl2 + mH2
\(\Rightarrow\)mHCl= (mZnCl2 + mH2) - mZn
\(\Rightarrow\)mHCl= (2,72 + 4) -1,3
\(\Rightarrow\)mHCl= 5,42
Hình như mZn bạn bị nhầm nên mik lm thành 1,3g

bài này quá dễ nha.Em dùng bảo toàn khối lượng là ra ngay nà
mZn + mHCl = mZnCl2 + mH2
=>mHCl =(mZnCl2 + mH2) - mZn
= (340+5) -162.5= 182.5g
vậy khối lượng HCl phản ứng là 182.5g
Chúc em học tốt !!!!:))

a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)

Bài 1 :
a.
Kẽm + Axit clohidric => Kẽm clorua + Khí hidro
\(m_{Zn}+m_{HClk}=m_{ZnCl_2}+m_{H_2}\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b.
Áp dụng định luật bảo toàn khối lượng :
\(m_{Zn}+m_{HCl\left(bđ\right)}=m_{ZnCl_2}+m_{H_2}+m_{HCl\left(dư\right)}\)
c.
Ta có :
\(\dfrac{n_{Zn}}{1}=\dfrac{6.5}{65}=0.1< \dfrac{n_{HCl}}{2}=\dfrac{10.95}{2}=0.15\)
\(\Rightarrow\) \(\text{HCl dư }\)
\(n_{ZnCl_2}=n_{Zn}=0.1\left(mol\right)\)
\(m_{ZnCl_2}=0.1\cdot136=13.6\left(g\right)\)
\(d.\)
\(n_{HCl\left(pư\right)}=0.1\cdot2=0.2\left(mol\right)\)
\(m_{HCl\left(pư\right)}=0.2\cdot36.5=7.3\left(g\right)\)

a) Zn + 2HCl --> ZnCl2 + H2
b) Theo ĐLBTKL: mZn + mHCl = mZnCl2 + mH2
=> mH2 = 5,2 + 5,84 - 10,88 = 0,16 (g)
c) \(n_{H_2}=\dfrac{0,16}{2}=0,08\left(mol\right)\)
=> VH2 = 0,08.22,4 = 1,792(l)

\(PTHH:Zn+2HCl->ZnCl_2+H_2\)
ap dung DLBTKL ta co
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(=>m_{H_2}=m_{Zn}+m_{HCl}-m_{ZnCl_2}\\ =>m_{H_2}=13+14,6-27,2\\ =>m_{H_2}=0,4\left(g\right)\)

a)
$m_{Zn} + m_{HCl} = m_{ZnCl_2} + m_{H_2}$
$\Rightarrow m_{Zn} = 13,6 + 0,2 - 7,3 = 6,5(gam)$
b)
$Zn + 2HCl \to ZnCl_2 + H_2$
c)
Tỉ lệ số nguyên tử Zn : số phân tử HCl : số phân tử $ZnCl_2$ : số phân tử $H_2$ là 1 : 2 : 1 : 1
\(a,Phản.ứng.hóa.học:Zn+HCl->ZnCl_2+H_2\)
Theo định luật bảo toàn khối lượng:
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\\ m_{Zn}+7,3g=13,6g+0,2g\\ m_{Zn}+7,3g=13,8g\\ m_{Zn}=13,8g-7,3g=6,5g\)
Vậy có 6,5g kẽm tham gia p/ứng.
\(b,PTHH:Zn+2HCl->ZnCl_2+H_2\)
c) Số nguyên tử Zn : Số phân tử HCl : Số phân tử ZnCl2 : Số phân tử H2 = 1:2:1:1
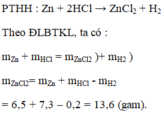
a) Phương trình chữ: Kẽm + Axit Clohidric \(--->\) Kẽm Clorua + Hidro
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b) Tỉ lệ 1 : 2 : 1 : 1
c) Bảo toàn khối lượng: \(m_{HCl}=m_{ZnCl_2}+m_{H_2}-m_{Zn}=3,9\left(g\right)\)