Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nzn=0,1mol
a) có pt : Zn + 2Hcl -> ZnCl2 + H2
1 -> 2 -> 1 -> 1 mol
0,1-> 0,2 -> 0,1 -> o,1 mol
b) số Hcl đã dùng khi pứ là :
0,2 . 36,5= 7,3
-> số gam hcl dư là 10,95- 7,3=3,65(g)
c)mZnCl2=0,1 . 136=13,6g

\(PTHH:Zn+2HCl->ZnCl_2+H_2\)
ap dung DLBTKL ta co
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(=>m_{H_2}=m_{Zn}+m_{HCl}-m_{ZnCl_2}\\ =>m_{H_2}=13+14,6-27,2\\ =>m_{H_2}=0,4\left(g\right)\)

\(a,m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\\ b,m_{H_2}=6,5+7,3-13,6=0,2\left(g\right)\)

a/Viết công thức về khối lượng của phản ứng
\(m_{Zn}+m_{HCl}=m_{ZnCl}+m_H\)
b/Cho biết khối lượng của Zn và HCI đã phản ứng là 6,5g và 7,3g,khối lượng của ZnCl2 là 13,6g.Hãy tính khối lượng của khí hidro bay lên
- Khối lượng của khí hidro bay lên là:
\(m_{H_2}=\left(6,5+7,3\right)-13,6=0,2g\)
a, mZn + mHCl = mZnCl2 + mH2
b, Theo phần a, ta có:
mH2 = mZn + mHCl - mZnCl2 = 6,5 + 7,3 - 13,6 = 0,2 (g)
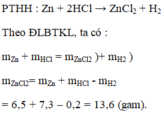
Bài 1 :
a.
Kẽm + Axit clohidric => Kẽm clorua + Khí hidro
\(m_{Zn}+m_{HClk}=m_{ZnCl_2}+m_{H_2}\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b.
Áp dụng định luật bảo toàn khối lượng :
\(m_{Zn}+m_{HCl\left(bđ\right)}=m_{ZnCl_2}+m_{H_2}+m_{HCl\left(dư\right)}\)
c.
Ta có :
\(\dfrac{n_{Zn}}{1}=\dfrac{6.5}{65}=0.1< \dfrac{n_{HCl}}{2}=\dfrac{10.95}{2}=0.15\)
\(\Rightarrow\) \(\text{HCl dư }\)
\(n_{ZnCl_2}=n_{Zn}=0.1\left(mol\right)\)
\(m_{ZnCl_2}=0.1\cdot136=13.6\left(g\right)\)
\(d.\)
\(n_{HCl\left(pư\right)}=0.1\cdot2=0.2\left(mol\right)\)
\(m_{HCl\left(pư\right)}=0.2\cdot36.5=7.3\left(g\right)\)