Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Cu đứng sau H nên Cu không phản ứng được với dung dịch HCl
Fe + 2HCl → FeCl 2 + H 2
0,1 mol ← 0,1 mol
=> m Fe = 0,1.56 = 5,6 gam => m Cu = 12 – 5,6 = 6,4 gam

Chọn B
Cho hỗn hợp chất rắn phản ứng với HCl dư có Cu không phản ứng.
Phương trình hóa học:
F e + 2 H C l → F e C l 2 + H 2 F e O + 2 H C l → F e C l 2 + H 2 O


Vì Cu ko tác dụng với H2SO4 loãng nên chất rắn dư sau p/ứ là Cu
\(\Rightarrow m_{Cu}=20(g)\\ \Rightarrow \%_{Cu}=\dfrac{20}{50}.100\%=40\%\)

m dd HCl = 1000.1,19 = 1190 g
Áp dụng định luật bảo toàn khối lượng ta có:
m hh + 1190 = 1200 + m H 2
Phương trình hóa học của phản ứng:
Zn + 2HCl → Zn Cl 2 + H 2
Fe + 2HCl → Fe Cl 2 + H 2
Qua phương trình hóa học trên, ta nhận thấy:
n H 2 = 1/2 n HCl ; n H 2 = 2,5/2 = 1,25 mol
m hh = 1200 - 1190 +(1,25x2) = 12,5g

Na 2 CO 3 + BaCl 2 → BaCO 3 + 2NaCl
Na 2 SO 4 + BaCl 2 → BaSO 4 + 2NaCl
2HCl + BaCO 3 → BaCl 2 + CO 2 + H 2 O
Kết tủa thu được gồm BaCO 3 , BaSO 4
Khí thoát ra là khí CO 2
Chất rắn còn lại không tan là BaSO 4
Theo các phương trình hoá học
n Na 2 CO 3 = n BaCO 3 = n CO 2 = 2,24/22,4 = 0,1 mol
Vậy m Na 2 CO 3 = 0,1 x 106 = 10,6 g → m Na 2 SO 4 = 24,8 - 10,6 = 14,2 g
→ n Na 2 SO 4 = 14,2/142 = 0,1 mol → m BaCO 3 = 0,1 x 197 = 19,7g
m BaSO 4 = 0,1 x 233 = 23,3g = b
→ a = 19,7 + 23,3 = 43g

\(n_{H_2}=\dfrac{7,437}{24,79}=0,3(mol)\\ PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow n_{Al}=\dfrac{2}{3}n_{H_2}=0,2(mol)\\ \Rightarrow m_{Al}=0,2.27=5,4(g)\\ \Rightarrow m_{Cu}=m_{hh}-m_{Al}=10-5,4=4,6(g)\)

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
____0,05<------------------------0,05
=> mFe = 0,05.56 = 2,8 (g)
=> mCu = 6 - 2,8 = 3,2 (g)
=> D
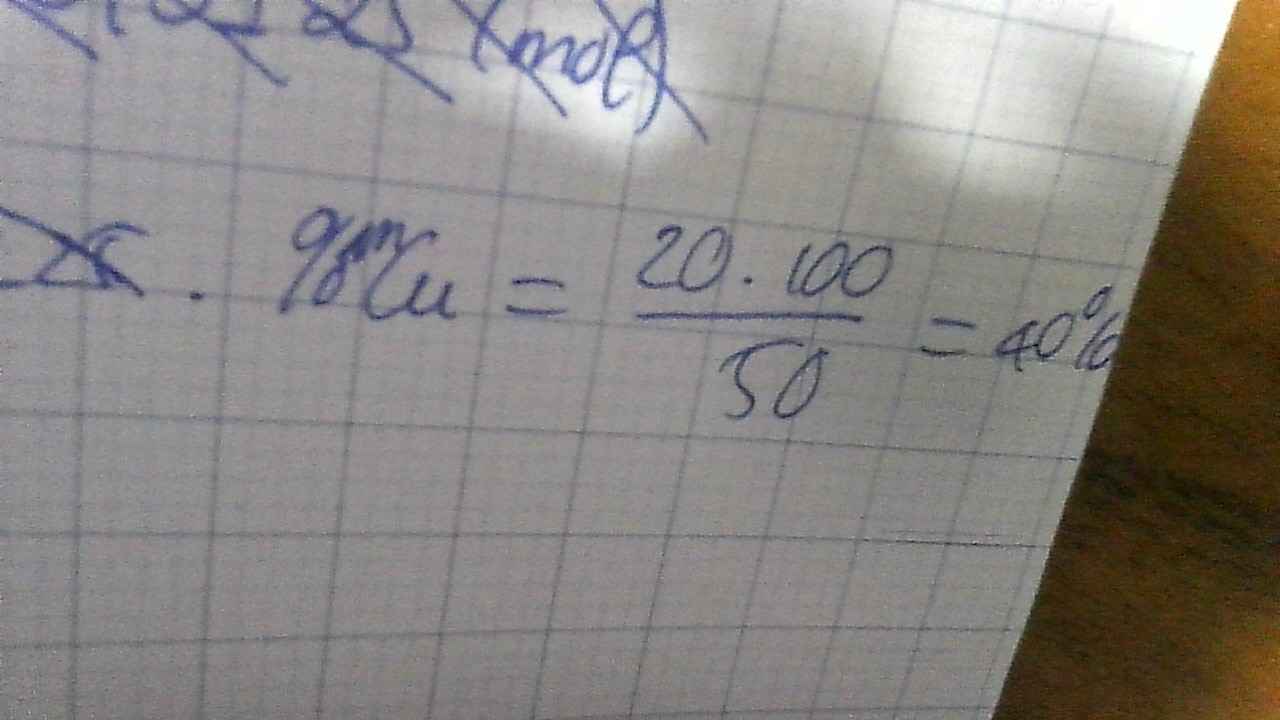
Sửa đề: Thoát ra \(2,479\) lít khí (đkc)
\(n_{H_2}=\dfrac{2,479}{24,79}=0,1(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow n_{Fe}=n_{H_2}=0,1(mol)\\ \Rightarrow m_{Fe}=0,1.56=5,6(g)\\ \Rightarrow m_{Cu}=m_{hh}-m_{Fe}=18,4(g)\\ \Rightarrow \begin{cases} \%_{Fe}=\dfrac{5,6}{24}.100\%\approx 23,3\%\\ \%_{Cu}=100\%-23,3\%=76,7\% \end{cases} \)
Vậy giá trị của m là \(18,4(g)\) và chọn đáp án D