Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Ta có phản ứng:
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
+ Ta có nCH3COOH = 0,4 mol và nC2H5OH = 0,5 mol
+ Từ số mol 2 chất ta xác định được hiệu suất tính theo số mol axit.
⇒ mEste = 0,4×0,6×88 = 21,12 gam

Lời giải:
nCH3COOH = 0,46
nC2H5OH = 0,6. Hiệu suất tính theo axit
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
⇒ neste = 0,46.50% = 0,23
⇒ m = 20,24g
Đáp án D.

Đáp án A
Hướng dẫn CH3COOH + C2H5OH ⇄ H 2 S O 4 đ , t o CH3COOC2H5 + H2O
nCH3COOC2H5 theo pt = nCH3COOH = 0,4 mol
Mà nCH3COOC2H5 thực tế thu được = 0,3 mol
=> H = nCH3COOC2H5 thực tế thu được / nCH3COOC2H5 theo pt = 0,3 / 0,4 = 75%

Đáp án C
Hướng dẫn Vì số mol ancol lớn hơn số mol axit nên ancol dư.
Số mol ancol pư = số mol axit = 0,2 mol
Áp dụng định luật bảo toàn khối lượng : mancol + maxit = meste + mnước
=> 0,2.46 + 12 = meste + 0,2.18 => meste = 17,6 gam
Nên H = 11.100 17 , 6 = 62,5%
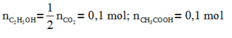
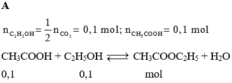
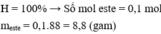

Đáp án A
Có n(CH3COOH) = 0,4 < n(C2H5OH) = 0,5
nên số mol este tính theo axit.
→ m(este thực tế) = 0,4.88.60% = 21,12 gam