Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
nP =62 : 31 = 2 (mol)
PTHH:4P + 5O2 --(to)-> 2P2O5
Theo PTHH: \(nO_2=\dfrac{5}{4}nP=\dfrac{5}{4}.2=2,5\left(mol\right)\)
VO2(đktc) = 2,5 ×22,4=56 (lít)
\(\dfrac{100\%}{21\%}.56=227\left(lít\right)\)
b)
\(nP=\dfrac{15,5}{31}=0,5\left(mol\right)\)
\(nO_2=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
0,4 0,5 0,2
tính theo pthh : => P dư , O2 đủ
nP(dư) = 0,5-0,4=0,1(mol)
=> mP (dư) = 0,1 . 31 = 3,1(g)
mP2O5 = 0,5 . 142=71(g)

\(n_P=\dfrac{m}{M}=0,2\left(mol\right)\)
- Ta có : \(V_{O_2}=\dfrac{V_{kk}}{5}=4,48\left(l\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=0,2\left(mol\right)\)
\(4P+5O_2\rightarrow2P_2O_5\)
- Theo phương pháp đường chéo ta có :
=> Sau phản ứng O2 phản ứng hết, P còn dư ( dư 0,04 mol )
Vậy sau phản ứng photpho không cháy hết .
b, - Chất được tạo thành là P2O5 .
Theo PTHH : \(n_{P2O5}=\dfrac{n_P}{2}=\dfrac{0,16}{2}=0,08\left(mol\right)\)
\(\Rightarrow m_{P2O5}=n.M=11,36\left(g\right)\)

Phương trình hóa học khi đốt cháy photpho:
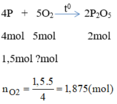
Thể tích của oxi cần: V O 2 = n O 2 .22,4 = 1,875.22,4 = 42(l)
Thể tích của không khí cần dùng là: V k k = 5 V O 2 = 5.42=210(l)

a)
\(4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
Sản phẩm : Điphotpho pentaoxit.
b)
\(n_P = \dfrac{6,2}{31} = 0,2(mol)\\ \Rightarrow n_{P_2O_5} = \dfrac{1}{2}n_P = 0,1(mol)\\ \Rightarrow m_{P_2O_5} = 0,1.142 = 14,2(gam)\)
c)
\(n_{O_2} = \dfrac{5}{4}n_P = 0,125(mol)\\ \Rightarrow V_{O_2} = 0,125.22,4 = 2,8(lít)\)
d)
\(V_{không\ khí} = \dfrac{2,8}{20\%} = 14(lít)\)

a) \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,2-->0,25
=> VO2 = 0,25.22,4 = 5,6 (l)
=> Vkk = 5,6.5 = 28 (l)
b)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,5<-----------------------------0,25
=> \(m_{KMnO_4}=0,5.158=79\left(g\right)\)

\(n_{P_2O_5}=\dfrac{21,3}{142}=0,15\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,3 0,375 0,15
\(\rightarrow\left\{{}\begin{matrix}m_P=0,3.31=9,3\left(g\right)\\V_{O_2}=0,375.22,4=8,4\left(l\right)\\V_{kk}=8,4.5=42\left(l\right)\end{matrix}\right.\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,25 0,375
=> mKClO3 = 0,25.122,5 = 30,625 (g)
\(nP_2O_5=\dfrac{21,3}{142}=0,15\left(mol\right)\)
\(pthh:4P+5O_2-t^o->2P_2O_5\)
0,3 0,375 0,15
=> \(m_P=0,3.31=9,3\left(g\right)\)
=>\(V_{O_2}=0,375.22,4=8,4\left(L\right)=>V_{KK}=8,4:20\%=42\left(L\right)\)
\(pthh:2KMnO_4-t^o->K_2MnO_4+MnO_2+O_2\)
0,75 0,75
=> mKMnO4 = 0,75 . 158 = 118,5 (G)

a) \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,4-->0,5------->0,2
=> \(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
b) \(V_{O_2}=0,5.22,4=11,2\left(l\right)\)
c) Vkk = 11,2.5 = 56 (l)

a. \(n_P=\frac{6,2}{31}=0,2mol\)
\(V_{O_2}=V_{kk}.\frac{1}{5}=\frac{18,48}{5}=3,696l\)
\(n_{O_2}=\frac{3,696}{22,4}=0,165mol\)
PTHH: \(4P+5O_2\xrightarrow{t^o}2P_2O_5\)
Tỷ lệ \(\frac{0,2}{4}>\frac{0,165}{5}\)
Vậy P dư
\(n_{P\left(\text{phản ứng }\right)}=\frac{4}{5}n_{O_2}=0,132mol\)
\(n_{P\left(dư\right)}=0,2-0,132=0,068mol\)
\(\rightarrow m_{P\left(dư\right)}=0,068.31=2,108g\)
b. \(n_{P_2O_5}=\frac{2}{5}n_{O_2}=0,066mol\)
\(\rightarrow m_{P_2O_5}=0,066.142=9,372g\)
c. PTHH: \(2KClO_3\xrightarrow{t^o}2KCl+3O_2\)
\(n_{KClO_3}=\frac{2}{3}n_{O_2}=0,11mol\)
\(\rightarrow m_{KClO_3}=0,11.122,5=13,475g\)

\(n_{CO_2}=\frac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH : \(C+O_2\underrightarrow{t^0}CO_2\)
PT : 1mol 1mol
Đề : 0,4mol ?mol
=> \(n_{O_2}=\frac{0,4\cdot1}{1}=0,4\left(mol\right)\)
=> \(V_{O_2}=0,4\cdot22,4=8,96\left(l\right)\)
\(V_{kk}\cdot20\%=V_{O_2}\Rightarrow V_{kk}=\frac{V_{O_2}}{20\%}=\frac{8,96}{20\%}=44,8\left(l\right)\)
=> \(V_{kk}=44,8l\)
a)
\(n_P = \dfrac{62}{31} = 2(mol)\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\\ n_{O_2} = \dfrac{5}{4}n_P = 2,5(mol)\\ V_{O_2} = 2,5.22,4 = 56(lít)\\ V_{không\ khí} = \dfrac{56}{20\%} = 280(lít)\)
b)
\(n_P = \dfrac{31}{31} = 1(mol) ; n_{O_2} = \dfrac{23}{32} = 0,71875(mol)\\ \dfrac{n_P}{4} = 0,25 > \dfrac{n_{O_2}}{5} = 0,14375 \to P\ dư\\ n_{P\ pư} = \dfrac{4}{5}n_{O_2} = 0,575(mol)\\ m_{P\ dư} = 31 - 0,575.31 = 13,175(gam)\\ n_{P_2O_5} = \dfrac{2}{5}n_{O_2} = 0,2875(mol) \Rightarrow m_{P_2O_5} = 0,2875.142=40,825(gam)\)
Ý b : 2 gam(lít) O2 là sao em ?