Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PT: \(C_6H_5OH+KOH\rightarrow C_6H_5OK+H_2O\)
Ta có: \(m_{KOH}=96.7\%=6,72\left(g\right)\Rightarrow n_{KOH}=\dfrac{6,72}{56}=0,12\left(mol\right)\)
Theo PT: \(n_{C_6H_5OH}=n_{KOH}=0,12\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{C_6H_5OH}=\dfrac{0,12.94}{16,08}.100\%\approx70,15\%\\\%m_{CH_3OH}\approx29,85\%\end{matrix}\right.\)
b, Trong 8,04 (g) X có: 0,06 mol C6H5OH và 0,075 mol CH3OH
PT: \(2C_6H_5OH+2Na\rightarrow2C_6H_5ONa+H_2\)
\(2CH_3OH+2Na\rightarrow2CH_3ONa+H_2\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{C_6H_5OH}+\dfrac{1}{2}n_{CH_3OH}=0,0675\left(mol\right)\Rightarrow V_{H_2}=0,0675.22,4=1,512\left(l\right)\)
\(\left\{{}\begin{matrix}n_{C_6H_5ONa}=n_{C_6H_5OH}=0,06\left(mol\right)\\n_{CH_3ONa}=n_{CH_3OH}=0,075\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow a=0,06.116+0,075.54=11,01\left(g\right)\)

Đáp án D
• 0,42 mol NaOH + 0,02 mol Fe2(SO4)3; 0,04 mol Al2(SO4)3 → 500ml X + ↓
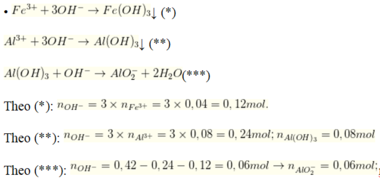
nAl(OH)3 = 0,08 - 0,06 = 0,02 mol
Vậy sau phản ứng 500ml dung dịch X gồm 0,06 mol Na[Al(OH)4]; 0,18 mol Na2SO4
→ CM các chất trong X là CMNa2SO4 = 0,06 : 0,5 = 0,12 M;
CMNa[Al(OH)4] = 0,18 : 0,5 = 0,36 M

Đáp án C
nNa2SO4= 0,15 mol; nMgSO4= 0,1 mol; nFe2(SO4)3=0,05 mol; nSO4(2-)=0,4 mol
Ba2+ + SO42-→ BaSO4
nBaSO4= nSO4(2-)= 0,4 mol; mBaSO4= 93,2 gam

Đáp án A
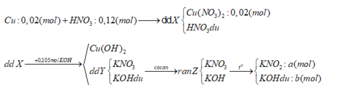
∑nKOH = a + b = 0,105 (1)
∑ mrắn = 85a + 56b = 8,78 (2)
Từ (1) và (2) => a = 0,1 (mol) ; b = 0,005 (mol)
nKNO3 tạo ra từ Cu(NO3)2 = 0,04 (mol)
=> nKNO3 tạo ra từ HNO3 dư = 0,1 – 0,04 = 0,06 (mo)
=> nHNO3 dư = 0,12- 0,06 = 0,06 (mol)
=> nHNO3 bị khử = 0,06 – 0,02.2 = 0,02 (mol)
Với ne( Cu nhường) = 2.nCu = 0,04 (mol) => Trung bình mỗi N+5 nhận 0,04/0,02 = 2e
=> Tạo NO2 (1e) và NO ( 3e)
=> nNO = nNO2 = 0,02/ 2= 0,01(mol)
Vậy mdd X = mCu + mdd HNO3 – m khí = 1,28 + 12,6 – 0,01.30 – 0,01.46 = 13,12 (g)
=> C% Cu(NO3)2 = [( 0,02.188) : 13,12].100% = 28,66%

Ta có: \(n_{Mg^{2+}}=n_{Mg\left(OH\right)_2}=\frac{0,87}{58}=0,015\left(mol\right)\)
Mặt khác ta lại có: \(n_{NH_4^+}=0,02\left(mol\right)\)
Gọi số mol \(Cu^{2+};SO_4^{2-}\) lần lượt là a;b
Ta có: \(\left\{{}\begin{matrix}98a+233b=5,64\\80a+233b=5,46\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,01\\b=0,02\end{matrix}\right.\)
Đến đây bảo toàn điện tích tìm \(n_{NO_3^-}\)

Đáp án B
P1: nFe(OH)3=nFe3+=1,07/107=0,01 mol
nNH3=nNH4+=0,672/22,4=0,03 mol
P2: nBaSO4=nSO4 2-=4,66/233=0,02 mol
BTĐT =>nNO3-=3nFe3++nNH4+-2nSO4 2-=0,02 mol
=> m chất tan trong 1 phần = 0,01.56+0,03.18+0,02.96+0,02.62=4,26 gam.
=> m chất tan trong X = 8,52 gam.
Chú ý:
Chia X thành 2 phần bằng nhau nên khi tính được 1 phần chúng ta cần nhân đôi để tính m.

Đáp án C
Trong 100ml dd X có 0,1 mol Ba2+, 0,15 mol .
Trong 200ml dung dịch X có 0,2 mol Cl-.
Do đó trong 50 ml dung dịch X có 0,05 mol Ba2+, 0,075 mol , 0,05 mol Cl- và x mol K+
Theo định luật bảo toàn điện tích được x = 0,025
Khi cô cạn xảy ra quá trình:


a) \(n_{KOH}=\dfrac{160.21\%}{56}=0,6\left(mol\right)\)
PTHH: \(Fe_2\left(SO_4\right)_3+6KOH\rightarrow2Fe\left(OH\right)_3\downarrow+3K_2SO_4\)
0,1<--------0,6--------->0,2
`=>` \(\left\{{}\begin{matrix}x=0,1.400=40\left(g\right)\\a=0,2.107=21,4\left(g\right)\end{matrix}\right.\)
\(n_{SO_4^{2-}}=0,5.0,9=0,45\left(mol\right)\)
Ta có: \(n_{SO_4^{2-}}=3n_{Fe_2\left(SO_4\right)_3}+n_{Na_2SO_4}\Rightarrow n_{Na_2SO_4}=0,45-0,1.3=0,15\left(mol\right)\)
`=>` \(y=0,15.142=21,3\left(g\right)\)
b) PT ion rút gọn: \(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
0,45----->0,45
`=>` \(m_{kt}=0,45.233=104,85\left(g\right)\)