Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo:
- CH4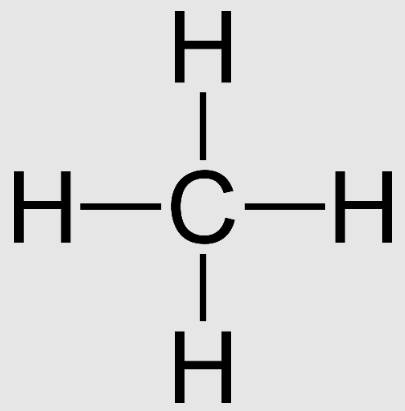
- C2H6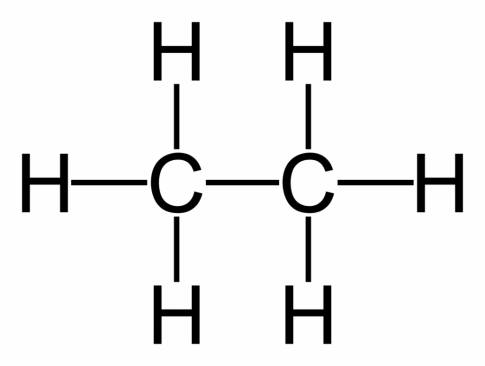
- C3H8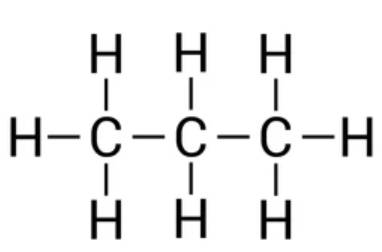
Trong phân tử alkane chỉ có các liên kết σ bền và kém phân cực. Mỗi nguyên tử carbon cũng như hydrogen đã tạo ra số liên kết cộng hoá trị lớn nhất của chúng. Vì thế, các alkane khó tham gia vào các phản ứng hoá học và phản ứng xảy ra sẽ kèm theo việc thay thế nguyên tử hydrogen hoặc bẻ gãy mạch carbon. Ở điều kiện thường, các alkane kém hoạt động, chúng không tác dụng với acid, kiềm và một số chất oxi hoá như dung dịch KMnO4, K2Cr2O7,... Các phản ứng tiêu biểu của alkane là phản ứng thế halogen (chlorine, bromine), phản ứng cracking, phản ứng reforming và phản ứng cháy.

1. Axetilen C 2 H 2 và benzen C 6 H 6 có cùng công thức đơn giản nhất là CH.
Axit axetic C 2 H 4 O 2 và glucozơ C 6 H 12 O 6 có cùng công thức đơn giản nhất là C H 2 O .
2. C H 3 - C H 2 - C H 2 - C H 3 và
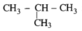
C H 3 - C H 2 -OH và C H 3 -O- C H 3 .

Trong phân tử nitrogen có liên kết ba bền vững với năng lượng liên kết lớn (945 kJ/mol).
Do đó ở nhiệt độ thường, phân tử nitrogen bền, khá trơ về mặt hóa học (khó phản ứng hóa học).

1. Công thức electron, công thức Lewis và công thức cấu tạo của phân tử nitrogen lần lượt là:
\(:N:::N:\\ :N\equiv N:\\ N\equiv N\)
2.
\(E_b\left(N_2\right)\) lớn vì giữa hai nguyên tử N có liên kết ba bền.
Do đó, nitrogen khá trơ ở điều kiện thường.