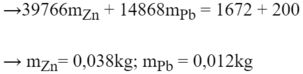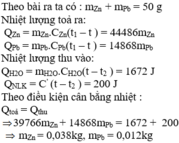Bài 29. Người ta bỏ một miếng hợp kim chi và kẽm có khối lượng 50 g ở nhiệt độ 136°C vào một nhiệt lượng kế có nhiệt dung 50 J/K chứa 100 g nước ở 14°C. Xác định khối lượng của kẽm và chỉ trong hợp kim trên. Biết nhiệt độ khi có sự cân bằng nhiệt trong nhiệt lượng kế là 18 °C. Cho nhiệt dung riêng của nước là 4180 J/kg.K; của kẽm là 337 J/kg. K; của chỉ là 126 J/kg.K.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo đề bài ta đc
\(m_1+m_2=0,1\\ \Rightarrow m_2=0,1-m_1\)
Ta có ptcbn
\(Q_{thu}=Q_{tỏa}\\ \Leftrightarrow0,1.4200\left(18-14\right)=m_1.210+\left(100-m_1\right)130\left(136-14\right)\\ \Rightarrow\left\{{}\begin{matrix}m_1\approx0,04\\m_2\approx0,06\end{matrix}\right.\)

Đáp án: B
Phương trình cân bằng nhiệt:
(Cnlk + mncn).(t – t1) = [mkck + (mhk – mk)cch].(t2 – t)
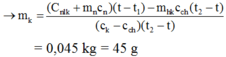
→ mch = mhk – mk = 5 g.

Gọi t1 là nhiệt độ ban đầu của miếng hợp kim, ta có t1=1240C
t2 là nhiệt độ ban đầu của nhiệt lượng kế và nước trong nhiệt lượng kế, ta có t2=160C
t=320C - nhiệt độ khi cân bằng trong nhiệt lượng kế
Nhiệt lượng toả ra:
Q Z n = m Z n . C Z n ( t 1 − t ) Q P b = m P b . C P b ( t 1 − t ) ⇔ = m Z n .337. ( 124 − 18 ) = 35722 m Z n = m P b .126. ( 124 − 18 ) = 13356 m P b
Nhiệt lượng thu vào:
Q H 2 O = m H 2 O . C H 2 O ( t − t 2 ) Q N L K = C ' ( t − t 2 ) ⇔ = 250 1000 .4180 ( 18 − 16 ) = 2090 J = 50. ( 18 − 16 ) = 100 J
Ta có, phương trình cân bằng nhiệt:
Q t o a = Q t h u ↔ 35722 m Z n + 13356 m P b = 2090 + 100 1
Mặt khác, theo đầu bài, ta có:
m Z n + m P b = 150 g = 0 , 15 k g 2
Từ (1) và (2), ta có:
35722 m Z n + 13356 m P b = 2190 m Z n + m P b = 0 , 15 → m Z n ≈ 8.10 − 3 k g m P b = 0 , 142 k g
Đáp án: A

Gọi t1 là nhiệt độ ban đầu của miếng hợp kim, ta có t1=1360C
t2 là nhiệt độ ban đầu của nhiệt lượng kế và nước trong nhiệt lượng kế, ta có t2=140C
t=180C - nhiệt độ khi cân bằng trong nhiệt lượng kế
Nhiệt lượng toả ra:
Q Z n = m Z n . C Z n ( t 1 − t ) Q P b = m P b . C P b ( t 1 − t ) ⇔ = m Z n .337. ( 136 − 18 ) = 39766 m Z n = m P b .126. ( 136 − 18 ) = 14868 m P b
Nhiệt lượng thu vào:
Q H 2 O = m H 2 O . C H 2 O ( t − t 2 ) = 100 1000 .4180 ( 18 − 14 ) = 1672 J Q N L K = C ' ( t − t 2 ) = 50. ( 18 − 14 ) = 200 J
Ta có, phương trình cân bằng nhiệt:
Q t o a = Q t h u ↔ 39766 m Z n + 14868 m P b = 1672 + 200 1
Mặt khác, theo đầu bài, ta có:
m Z n + m P b = 50 g = 0 , 05 k g 2
Từ (1) và (2), ta có:
39766 m Z n + 14868 m P b = 1872 m Z n + m P b = 0 , 05 → m Z n = 0 , 045 k g m P b = 4 , 67.10 − 3 ≈ 0 , 005 k g
Đáp án: A

Gọi m1 là khối lượng của chì, m2 là khối lượng của kẽm, m là khối lượng của hợp kim:
m = m1 + m2 = 0,05kg (1)
Nhiệt lượng chì và kẽm tỏa ra:
Q1 = m1.c1.(t0 - t) = m1.130.(136 – 18) = 15340.m1
Q2 = m2.c2.(t0 - t) = m2.210.(136 – 18) = 24780.m2
Nhiệt lượng nước thu vào:
Qn = mn.cn.(t - tn) = 0,05.4200.(18 - 14) = 810J
Vì muốn cho nhiệt lượng kế nóng thêm lên 1oC thì cần 65,1J nên nhiệt lượng kế thu vào:
Q4 = Qk.(t – tn) = 65,1.(18 – 14) = 260,4J
Vì nhiệt lượng tỏa ra bằng nhiệt lượng thu vào nên: Q3 + Q4 = Q1 + Q2
↔ 15340.m1 + 24780.m2 = 1100,4 (2)
Từ (1), rút m2 = 0,05 – m1, thay vào phương trình (2), giải ra ta được:
m1 = 0,015kg, suy ra m2 = 0,035kg
Vậy khối lượng chì là 15 gam và khối lượng kẽm là 35 gam.