khi cho hơi nước qua sắt nung đỏ ở 450 tới 500 độ c để điều chế h2 có thể đốt sắt lên 1400 độ c không
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án A
Phát biểu không đúng:
(a) Sai. Vì phản ứng theo hai hướng
(c) Sai
(d) Sai. Nhôm là nguyên tố phổ biến thứ 3 sau oxi và silic.
(e) Sai. Ở nhiệt độ khoảng 3000°C
(f) Sai. Không thể dập đám cháy có Mg bằng CO2 vì 2Mg + CO2 ® C + 2MgO sau đó C cháy làm đám cháy càng to hơn.
(g) Sai. Vì Ag3PO4 tan trong HNO3.
(h) Sai. Vì Apatit có công thức là 3Ca3(PO4)2.CaF2 còn : Ca3(PO4)2 là photphorit
(a) Sai. Vì phản ứng theo hai hướng

Nhiệt lượng do sắt toả ra : Q = m 1 c 1 t 1 - t
Nhiệt lượng do nước thu vào : Q 2 = m 2 c 2 t - t 2
Vì Q 1 = Q 2 nên : m 1 c 1 t 1 - t = m 2 c 2 t - t 2
t 1 ≈ 1 346 ° C

a) \(n_O=\dfrac{34,8-25,2}{16}=0,6\left(mol\right)\)
=> \(n_{H_2O}=0,6\left(mol\right)\) (bảo toàn O)
=> \(n_{H_2}=0,6\left(mol\right)\) (bảo toàn H)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
b) \(n_{Fe}=\dfrac{25,2}{56}=0,45\left(mol\right)\)
nFe : nO = 0,45 : 0,6 = 3 : 4
=> CTHH: Fe3O4
c) \(m_{H_2O}=0,6.18=10,8\left(g\right)\)
Mà \(d_{H_2O}=1\left(g/ml\right)\)
=> \(V_{H_2O}=10,8\left(ml\right)\)

Tóm tắt:
m1= 3kg
m2= 2,5kg
t= 500°C
t1= 300°C
t2= 2000°C
C1= 460 J/kg.K
C2= 4200J/kg.K
----------------------
Nhiệt lượng cần thiết để khối sắt nóng từ 300°C đến 2000°C là:
Q1= m1*C1*(t2-t1)= 3*460*( 2000-300)= 2346000(J)
Nhiệt lượng của khối sắt tỏa ra khi cho vào 2,5kg nước:
Q2= m1*C1*(t2-t)= 3*460*(2000-500)= 2070000(J)
Nhiệt lượng mà 2,5kg nước thu vào là:
Q3= m2*C2*(t-t3)= 2,5*4200*(500-t3)
* Theo bài ta có phương trình cân bằng nhiệt:
Q2=Q3
<=> 2070000= 2,5*4200*(500-t3)
=> t3= 302,8°C
=>> Vậy nhiệt độ ban đầu của 2,5kg nước là 302,8°C

\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1 0,3 0,2
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
LTL: \(\dfrac{0,2}{3}>\dfrac{0,1}{2}\rightarrow\) Fe dư
Theo pthh: \(n_{Fe\left(pư\right)}=\dfrac{3}{2}n_{O_2}=\dfrac{3}{2}.0,1=0,15\left(mol\right)\)
\(\rightarrow m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\)
a.\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,1 0,3 0,2 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_{O_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
\(\dfrac{0,2}{3}\) > \(\dfrac{0,1}{2}\) ( mol )
0,15 0,1 ( mol )
Chất dư là Fe
\(m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8g\)

a. \(n_{Fe_3O_4}=\dfrac{6,96}{232}=0,03\left(mol\right)\)
PTHH : 3Fe + 2O2 -to-> Fe3O4
0,09 0,06 0,03
\(m_{Fe}=0,09.56=5,04\left(g\right)\)
\(V_{O_2}=0,06.22,4=1,344\left(l\right)\)
b. PTHH : 2KCl + 3O2 -> 2KClO3
0,06 0,04
\(m_{KClO_3}=0,04.122,5=4,9\left(g\right)\)

Nhiệt lượng do nhiệt lượng kế thu vào :
Q 3 = m 3 c 3 t - t 2
Ta có Q 1 = Q 2 + Q 3 . Từ đó tính được : t 1 ≈ 1 405 ° C
Sai số tương đối là :
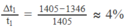

Giả sử : \(m_{dd_{H_2SO_4\left(bđ\right)}}=100\left(g\right)\) , \(n_{H_2O\left(\text{hấp thụ}\right)}=a\left(mol\right)\)
Khi đó :
\(m_{H_2SO_4\left(bđ\right)}=98\%\cdot100=98\left(g\right)\)
Sau khi hấp thụ :
\(m_{dd_{H_2SO_4}}=18a+100\left(g\right)\)
\(C\%_{H_2SO_4}=\dfrac{98}{18a+100}\cdot100\%=92.979\%\)
\(\Rightarrow a=0.3\)
\(n_{O\left(oxit\right)}=n_{H_2O}=0.3\left(mol\right)\) \(\Rightarrow m_O=0.3\cdot16=4.8\left(g\right)\)
\(m_{Fe}=32-4.8=27.2\left(g\right)\) \(\Rightarrow n_{Fe}=\dfrac{27.2}{56}=\dfrac{17}{35}\left(mol\right)\)
\(n_{Fe}:n_O=\dfrac{17}{35}:0.3=34:21\)
Tới đây em xem lại khối lượng của oxit sắt ban đầu nha.
Ko