Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,05 0,1 0,15
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(a,m_{Fe_2O_3}=0,05.8\left(g\right)\)
\(b,H_2SO_4+Fe\rightarrow FeSO_4+H_2\uparrow\)
0,15 0,15 0,15
\(m_{ddH_2SO_4}=\dfrac{0,15.98.100}{50}=29,4\left(g\right)\)
\(m_{Fe}=\dfrac{0,15.56.100}{50}=16,8\left(g\right)\)

nFe = 46,4/56 = 29/35 (mol)
PTHH: 4Fe + 3O2 -> (t°) 2Fe2O3
Mol: 29/35 ---> 87/140 ---> 29/70
mFe2O3 = 29/70 . 160 = 464/7 (g)
Vkk = 87/140 . 5 . 22,4 = 69,6 (l)

Bài 1: Số mol Al là 10,8/27=0,4 (mol).
4Al (0,4 mol) + 3O2 (0,3 mol) \(\underrightarrow{t^o}\) 2Al2O3.
a) Thể tích khí oxi cần dùng ở đktc là 0,3.22,4=6,72 (lít).
b) 2KMnO4 (0,6 mol) \(\underrightarrow{t^o}\) K2MnO4 + MnO2\(\downarrow\) + O2\(\uparrow\) (0,3 mol).
Khối lượng KMnO4 cần dùng là 0,6.158=94,8 (g).
Bài 2:
a) Fe2O3 (0,15 mol) + 3H2 (0,45 mol) \(\underrightarrow{t^o}\) 2Fe (0,3 mol) + 3H2O.
b) Khối lượng Fe2O3 cần dùng là 0,15.160=24 (g).
c) Thể tích khí hiđro đã dùng (đktc) là 0,45.22,4=10,08 (lít).
Bài 3: Số mol magie và axit sunfuric lần lượt là 3,6/24=0,15 (mol) và 24,5/98=0,25 (mol), H2SO4 dư.
Mg (0,15 mol) + H2SO4 (0,15 mol) \(\rightarrow\) MgSO4 + H2\(\uparrow\) (0,15 mol).
Thể tích khí hiđro thu được ở đktc là 0,15.22,4=3,36 (lít).
Bài 1:
Số mol của Al là:
nAl=10,8/27=0,4(mol)
PTHH: Al + O2 → Al2O3
0,4 → 0,4→ 0,4 (mol)
a)Thể tích của oxi ở đktc là:
VO2=0,4*22,4=8,96(l)
b) PTHH: 2KMnO4 → O2 + MnO2 + K2MnO4
0,8 0,4
Khối lượng của KMnO4 là:
mKMnO4=0,8*158=126,4(g)
Bài 2:
Số mol của sắt là:
nFe=16,8/56=0,3(mol)
a) PTHH: 4Fe + 3O2 → 2Fe2O3
0,3→0,225→ 0,15 (mol)
b) Khối lượng của Fe2O3 là:
mFe2O3=0,15*160=24(g)
c) Thể tích hidro cần dùng là:
VH2=0,225*22,4=5,04 (l)

PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,02\left(mol\right)\\n_{Fe}=0,03\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,03\cdot56=1,68\left(g\right)\\V_{O_2}=0,02\cdot22,4=0,448\left(l\right)\end{matrix}\right.\)

Ta có: \(n_{H_2}=\dfrac{7,392}{22,4}=0,33\left(mol\right)\)
Gọi: nH2 (pư) = a (mol) ⇒ nH2 (dư) = 10%a (mol)
⇒ a + 10%a = 0,33
⇒ a = 0,3 (mol)
Có: \(H_2+O_{\left(trongoxit\right)}\rightarrow H_2O\)
⇒ nO (trong oxit) = 0,3 (mol)
\(\Rightarrow n_{Fe}=\dfrac{16-m_{O\left(trongoxit\right)}}{56}=0,2\left(mol\right)\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{0,2}{0,3}=\dfrac{2}{3}\)
Vậy: CTHH cần tìm là Fe2O3.

nFe3O4 = 2,32/232 = 0,01 mol
3Fe + 2O2 ➝ Fe3O4
0,03 0,02 0,01 (mol)
a) mFe = 0,03.56 = 1,68 gam
b) VO2 = 0,02.22,4 = 0,448 lít

Bài 1:
\(a.PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ n_{Fe_3O_4}=\dfrac{m}{M}=0,3\left(mol\right)\)
Từ PTHH trên ta có:
3 mol sắt tác dụng với 2 mol khí oxi thì sinh ra 1 mol oxit sắt từ
=> 0,9 mol sắt tác dụng với 0,6 mol khí oxi thì sinh ra 0,3 mol oxit sắt từ
\(\Rightarrow m_{Fe}=0,9.56=50,4\left(g\right)\\ b.\Rightarrow V_{O_2}=0,6.22,4=13,44\left(l\right)\)
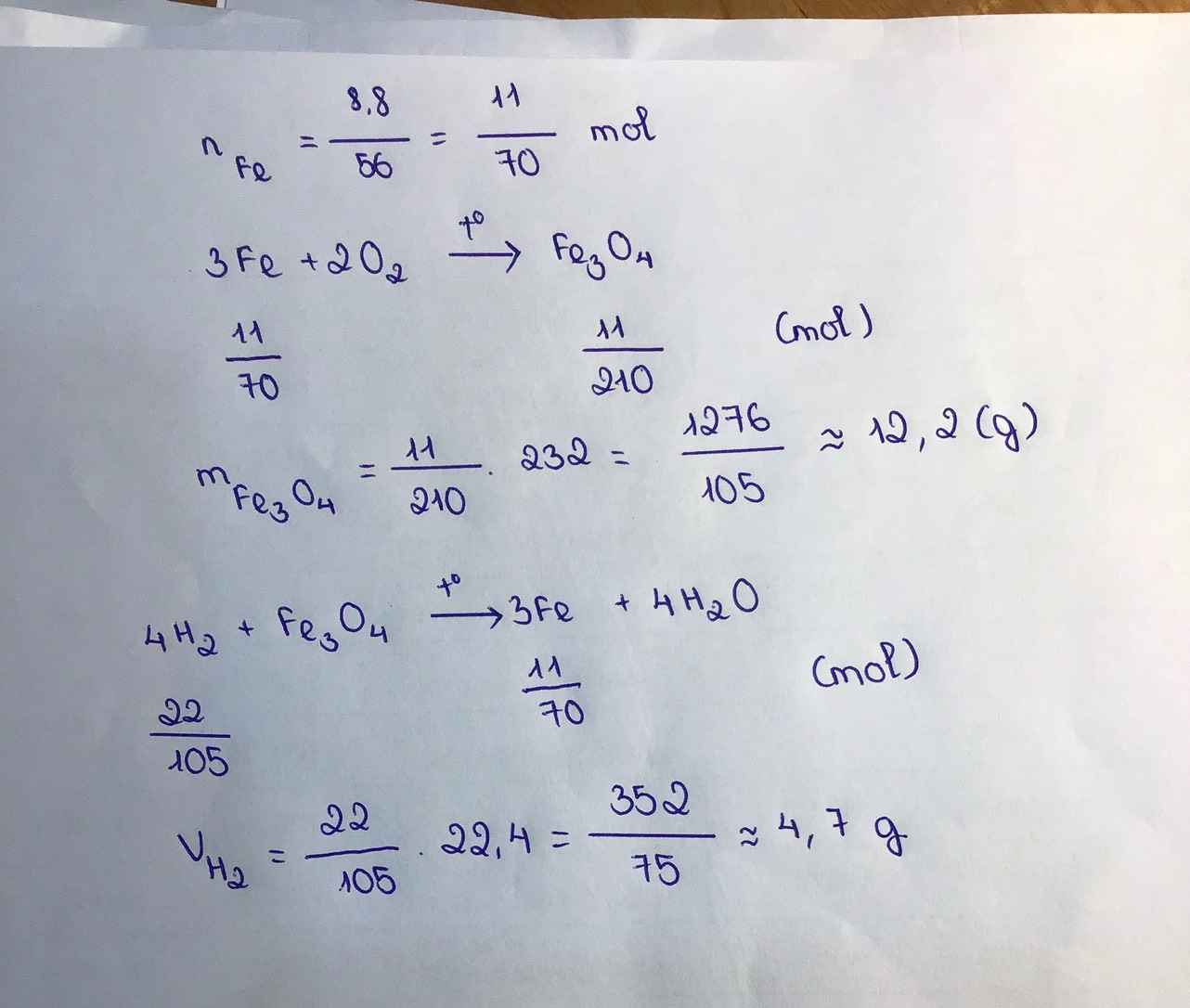


\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1 0,3 0,2
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
LTL: \(\dfrac{0,2}{3}>\dfrac{0,1}{2}\rightarrow\) Fe dư
Theo pthh: \(n_{Fe\left(pư\right)}=\dfrac{3}{2}n_{O_2}=\dfrac{3}{2}.0,1=0,15\left(mol\right)\)
\(\rightarrow m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\)
a.\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,1 0,3 0,2 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_{O_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
\(\dfrac{0,2}{3}\) > \(\dfrac{0,1}{2}\) ( mol )
0,15 0,1 ( mol )
Chất dư là Fe
\(m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8g\)