Cho 1,42gg P2O5 vào nước để tạo thành dung dịch A tính khối lượng axit photphoric thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$n_{P_2O_5} = 0,2(mol) ; n_{H_2O} = 5(mol)$
$P_2O_5 + H_2O \to 2H_3HO_4$
Ta thấy : $n_{P_2O_5} < n_{H_2O}$ nên $H_2O$ dư
$n_{H_3PO_4} = 2n_{P_2O_5} = 0,4(mol)$
$m_{H_3PO_4} = 0,4.98 = 39,2(gam)$
\(n_{P_2O_5}=\dfrac{28.4}{142}=0.2\left(mol\right)\)
\(n_{H_2O}=\dfrac{90}{18}=5\left(mol\right)\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(1.........3\)
\(0.2..........5\)
\(LTL:\dfrac{0.2}{1}< \dfrac{5}{3}\Rightarrow H_2Odư\)
\(m_{H_3PO_4}=0.2\cdot2\cdot98=39.2\left(g\right)\)

\(n_{SO_3}=\dfrac{20}{80}=0,25\left(mol\right)\\ PTHH:SO_3+H_2O\rightarrow H_2SO_4\\ Mol:0,25\rightarrow0,25\rightarrow0,25\\ C_{MH_2SO_4}=\dfrac{0,25}{0,5}=0,5M\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\\ Mol:0,25\leftarrow0,25\\ m_{Mg}=0,25.24=6\left(g\right)\)

a, \(n_{P_2O_5}=\dfrac{21,3}{142}=0,15\left(mol\right)\)
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
Theo PT: \(n_{H_3PO_4}=2n_{P_2O_5}=0,3\left(mol\right)\)
\(\Rightarrow m_{H_3PO_4}=0,3.98=29,4\left(g\right)\)
b, m dd sau pư = 21,3 + 300 = 321,3 (g)
\(\Rightarrow C\%_{H_3PO_4}=\dfrac{29,4}{321,3}.100\%\approx9,15\%\)

\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\\ a,n_{P_2O_5}=n_{H_2O}:3=0,2:3=\dfrac{1}{15}\left(mol\right)\\ \Rightarrow m_{P_2O_5}=\dfrac{142.1}{15}=\dfrac{142}{15}\left(g\right)\\ b,n_{H_3PO_4}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ \Rightarrow m_{H_3PO_4}=98.\dfrac{2}{15}=\dfrac{196}{15}\left(g\right)\)

\(n_{P_2O_5}=\dfrac{10,65}{142}=0,075\left(mol\right)\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\\ n_{H_3PO_4}=0,075.2=0,15\left(mol\right)\\ C\%_{ddH_3PO_4}=\dfrac{0,15.98}{200}.100=7,35\%\)

Phương trình phản ứng:
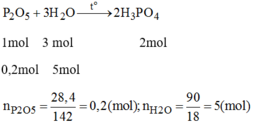
Tỉ lệ mol:
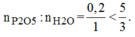
Vậy H 2 O dư và P 2 O 5 hết.
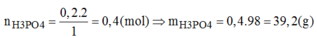
→ Chọn C.

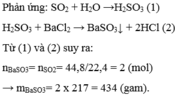
Ta có: \(n_{P_2O_5}=\dfrac{1,42}{142}=0,01\left(mol\right)\)
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
___0,01_____________0,02 (mol)
\(\Rightarrow m_{H_3PO_4}=0,02.98=1,96\left(g\right)\)
Bạn tham khảo nhé!
\(n_{P_2O_5}=\dfrac{1.42}{142}=0.01\left(mol\right)\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(0.01......................0.02\)
\(m_{H_3PO_4}=0.02\cdot98=1.96\left(g\right)\)