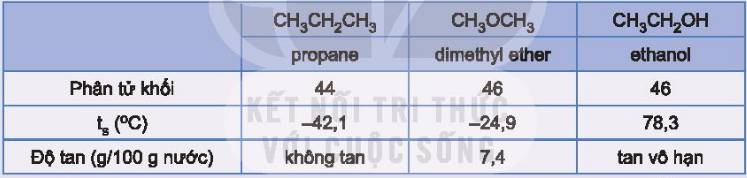
Ethanol và dimethyl ether có cùng công thức phân tử là C2H6O. Tuy nhiên, dimethyl ether hầu như không tan trong nước và sôi ở -24 oC, còn ethanol tan vô hạn trong nước và sôi ở 78 oC; dimethyl ether không tác dụng với sodium, trong khi ethanol tác dụng với sodium giải phóng hydrogen, … Điều gì gây ra sự khác biệt về tính chất của hai hợp chất có cùng công thức phân tử này?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do các phân tử ethanol có thể tạo liên kết hydrogen với nhau và với nước.

Giữa các phân tử ethanol có liên kết hydrogen liên phân tử; propane và dimethyl ether không có liên kết hydrogen, do đó ethanol có nhiệt độ sôi cao hơn hẳn so với propane và dimethyl ether.

\(Ethanol:CH_3-CH_2-OH\\ Dimethyl.ether:CH_3-O-CH_3\)
CTPT giống nhau nhưng khác nhau ở CTCT (liên kết của nguyên tử O)
Khả năng phản ứng của 2 chất này với sodium: ethanol có phản ứng, chất còn lại thì không
\(PTHH:CH_3-CH_2-OH+Na\rightarrow CH_3-CH_2-ONa+\dfrac{1}{2}H_2\)

Ethanol và dimethyl ether giống nhau về thành phần phân tử nhưng khác nhau về cấu tạo hóa học. Tính chất cơ bản của 2 chất này khác nhau.

Theo nguyên tử khối của Halogen, ta sẽ có: \(M_F< M_{Cl}< M_{Br}< M_I\)
Do đó: Nhiệt độ sôi tương ứng của chúng sẽ tăng dần
=> Nhiệt độ sôi của CH3F, CH3Cl, CH3Br, CH3I lần lượt là -78 độ C, -24 độ C, 4 độ C và 24 độ C
Do liên kết của nguyên tử O trong phân tử ở các vị trí khác nhau.