Ethyl iodide có khối lượng riêng là 1,94 g mL-1 và có nhiệt độ sôi là 72 °C. Ethanol có khối lượng riêng là 0,789 g mL-1 và có nhiệt độ sôi là 78 °C. Ethanol tan trong nước còn ethyl iodide kém tan trong nước nhưng tan được trong ethanol. Ethyl iodide thường được điều chế từ ethanol và sản phẩm thu được thường bị lẫn ethanol. Đề xuất phương pháp tinh chế ethyl iodide từ hỗn hợp của chất này với ethanol.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C.
Lượng nhiệt cần dùng để làm tăng nhiệt độ của 1000 gam nước từ 25°C lên 100°C là:
Q = m.C nước. ∆ t ∘ = 1000.4,16.(100 - 75) = 312000 J = 312 kJ.
Trong 100 gam khí gas trên có 99,4 gam butan và 0,6 gam pentan nên lượng nhiệt tỏa ra khi đốt cháy 100 gam khí gas là:
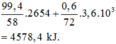
Vậy lượng khí gas cần dùng là 312.100.4578,4 ≈ 6,81 gam.

Do các phân tử ethanol có thể tạo liên kết hydrogen với nhau và với nước.

- Gọi nhiệt độ ban đầu của ca nhôm là t .
- Nhiệt lượng của chiếc ca bằng nhôm là : \(Q_1=\left(m_1c_1+m_2c_2\right)\left|t-t_1\right|\)
- Nhiệt lượng của chiếc bình đồng là : \(Q_2=m_3c_3\left|t_2-t_1\right|\)
Do nhiệt lượng tỏa ra môi trường không đáng kể nên ta có phương trình cân bằng nhiệt: Q1=Q2
\(\Leftrightarrow m_3c_3\left|t_1-t_2\right|=\left(m_1c_1+m_2c_2\right)\left|t-t_1\right|\)
\(\Leftrightarrow4428\left|100-82\right|=1436.\left|x-82\right|\)
\(\Leftrightarrow\left|x-82\right|=\dfrac{19926}{359}\)
\(\Leftrightarrow t\approx26,5^o\)
Vậy ...

\(=>Qthu=Qthu1+Qthu2\)
\(=>Qthu=\left(m1.c1+m2.c2\right)\left(t1-t2\right)=\left(0,5.880+2.4200\right)\left(100-25\right)\)
\(=>Qthu=663000J\)

Do liên kết của nguyên tử O trong phân tử ở các vị trí khác nhau.

Tóm tắt:
\(m=3kg\)
\(t_1=30^oC\)
\(c=4200J/kg.K\)
========
a) \(t_2=100^oC\)
\(Q=?J\)
b) \(t_3=50^oC\)
\(Q_2=?J\)
a) Nhiệt lượng nước cần phải cung cấp để đun cho nước nóng lên:
\(Q=m.c.\left(t_2-t_1\right)=3.4200.\left(100-30\right)=882000J\)
b) Khi nguội xuống còn 50oC thì nhiệt lượng mà nước tỏa ra là:
\(Q_2=m.c.\left(t_2-t_3\right)=3.4200.\left(100-50\right)=630000J\)

a.
Ta có: \(Q_n=mc\left(t_2-t_1\right)=m\cdot4200\cdot\left(100-20\right)\)
\(\Rightarrow m=2\left(kg\right)\)
b.
Ta có: \(\left\{{}\begin{matrix}Q_n=2\cdot4200\cdot80=672000\left(J\right)\\Q_{Al}=0,2\cdot880\cdot80=14080\left(J\right)\end{matrix}\right.\)
\(\Rightarrow Q=Q_n+Q_{Al}=672000+14080=686080\left(J\right)\)
c.
Ta có: \(Q_n=mc\left(t_2-t_1\right)=3,5\cdot4200\cdot\left(t_2-20\right)\)
\(\Rightarrow t_2\approx66^0C\)
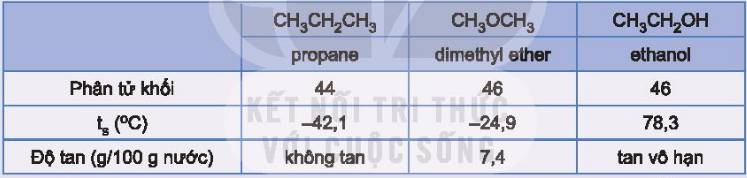
- Ta có thể sử dụng các phương pháp chiết lỏng – lỏng ethyl iodide để tách ethyl iodide ra khỏi hỗn hợp. Vì các lý do sau:
+ Ethyl iodide kém tan trong nước, còn ethanol tan tốt trong nước.
+ Khối lượng riêng của ethyl iodide lớn hơn nhiều so với khối lượng riêng của ethanol.
- Phương pháp chiết lỏng – lỏng ethyl iodide được thực hiện như sau:
Ethyl iodide kém tan trong nước, còn ethanol tan tốt trong nước nên ta chọn nước là dung môi. Cho dung dịch gồm ethyl iodide, ethanol vào phễu chiết, thêm nước vào. Lắc đều phễu chiết rồi để yên, hỗn hợp sẽ tách thành hai lớp: một lớp là hỗn hợp ethanol và nước nhẹ hơn ở trên, một lớp là ethyl iodide nặng hơn ở dưới. Mở khoá phễu chiết ta thu được ethyl iodide. Làm bay hơi dung môi từ dịch chiết để được ethyl iodide cần phân tách.