Đốt cháy hoàn toàn 20g bột Fe và S phải dùng hết 6,72l khí Oxi (đktc)
a)tính thành phần phần trăm về khối lượng của mỗi chất
b)tính khối lượng của mỗi sản phẩm thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo ĐLBT KL, có: mCu + mO2 = mCuO
⇒ mCu = mCuO - mO2 = 32 - 6,4 = 25,6 (g)
⇒ m tạp chất = 26 - 25,6 = 0,4 (g)
\(\Rightarrow\%m_{tapchat}=\dfrac{0,4}{26}.100\%\approx1,54\%\)

a/ \(2CO\left(0,2\right)+O_2\left(0,1\right)\rightarrow2CO_2\left(0,2\right)\)
\(2H_2\left(0,1\right)+O_2\left(0,05\right)\rightarrow2H_2O\left(0,1\right)\)
\(n_{H_2O}=\frac{1,8}{18}=0,1\)
\(n_{O_2}=\frac{3,36}{22,4}=0,15\)
Số mol O2 phản ứng ở phản ứng đầu là: \(0,15-0,05=0,1\)
\(\Rightarrow m_{CO_2}=0,2.44=8,8\)
b/ \(m_{CO}=0,2.28=5,6\)
\(m_{H_2}=0,1.2=0,2\)
c/ \(\%CO=\frac{0,2}{0,3}.100\%=66,67\%\)
\(\Rightarrow\%H_2=100\%-66,67\%=33,33\%\)

a)
Gọi số mol C2H5OH, CH3COOH là a, b (mol)
\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\); \(n_{CaCO_3}=\dfrac{40}{100}=0,4\left(mol\right)\)
PTHH: C2H5OH + 3O2 --to--> 2CO2 + 3H2O
a----->3a-------->2a
CH3COOH + 2O2 --to--> 2CO2 + 2H2O
b------>2b-------->2b
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,4<----0,4
=> \(\left\{{}\begin{matrix}3a+2b=0,5\\2a+2b=0,4\end{matrix}\right.\) => a = 0,1 (mol); b = 0,1 (mol)
a = 0,1.46 + 0,1.60 = 10,6 (g)
b) \(\left\{{}\begin{matrix}\%m_{C_2H_5OH}=\dfrac{0,1.46}{10,6}.100\%=43,4\%\\\%m_{CH_3COOH}=\dfrac{0,1.60}{10,6}.100\%=56,6\%\end{matrix}\right.\)
c)
PTHH: 2CH3COOH + Na2CO3 --> 2CH3COONa + CO2 + H2O
0,1----------------------------------->0,05
B là khí CO2
V = 0,05.22,4 = 1,12 (l)

Khi A tác dụng với O 2 chỉ sinh ra, và H 2 O , vậy A có chứa cacbon, hiđro, có thể có hoặc không có oxi.
Theo định luật bảo toàn khối lượng :
m C O 2 + m H 2 O = m A + m O 2 = 7,30 (g) (1)
Theo đầu bài: m C O 2 + m H 2 O = 3,70(g). (2)
Từ hệ (1) và (2), tìm được m C O 2 = 5,50 g; m H 2 O = 1,80 g.
Khối lượng C trong 5,50 g
C
O
2
: 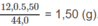
Khối lượng H trong 1,8 g
H
2
: 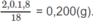
Đó cũng là khối lượng c và H trong 2,50 g chất A. Vậy chất A phải chứa O.
Khối lượng O trong 2,50 g A: 2,50 - 1,50 - 0,200 = 0,80 (g)
Phần trăm khối lượng của C: 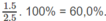
Phần trăm khối lương của H: 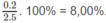
Phần trăm khối lương của O: 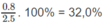

a) \(n_{SO_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,5<-0,5<------0,5
=> mS = 0,5.32 = 16(g)
=> \(\left\{{}\begin{matrix}\%m_S=\dfrac{16}{22,2}.100\%=72,07\%\\\%m_P=\dfrac{22,2-16}{22,2}.100\%=27,93\%\end{matrix}\right.\)
b) \(n_P=\dfrac{22,2-16}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,2-->0,25----->0,1
=> \(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
c)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,5<-------------------0,75
=> \(m_{KClO_3}=0,5.122,5=61,25\left(g\right)\)
a) PTHH:
\(S+O_2\rightarrow\left(t^o\right)SO_2\\ 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
- Chất khí mùi hắc là SO2
- Chất rắn sau phản ứng có m(g) là P2O5
Đặt: nS=a(mol); nP=b(mol) (a,b>0) (nguyên, dương)
\(\Rightarrow\left\{{}\begin{matrix}32a+31b=22,2\\22,4a=11,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,5\\b=0,2\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}\%m_S=\dfrac{0,5.32}{22,2}.100\approx72,072\%\\\%m_P\approx100\%-72,072\%\approx27,928\%\end{matrix}\right.\)
b)
\(n_{O_2}=a+\dfrac{5}{4}b=0,5+\dfrac{5}{4}.0,2=0,75\left(mol\right)\\ \Rightarrow V_{O_2\left(đktc\right)}=0,75.22,4=16,8\left(l\right)\)
c)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2.0,75}{3}=0,5\left(mol\right)\\ \Rightarrow m_{KClO_3}=122,5.0,5=61,25\left(g\right)\)

\(n_{P_2O_5}=\dfrac{28,4}{142}=0,2\left(mol\right)\)
\(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,4<--------------0,2
S + O2 --to--> SO2
0,25<----------0,25
=> \(\left\{{}\begin{matrix}\%m_P=\dfrac{0,4.31}{0,4.31+0,25.32}.100\%=60,78\%\\\%m_S=\dfrac{0,25.32}{0,4.31+0,25.32}.100\%=39,22\%\end{matrix}\right.\)

- Gọi mol metan và etan là x, y ( mol )
\(x+y=n_{hh}=\dfrac{V}{22,4}=0,25\left(mol\right)\)
Lại có : \(x+2y=n_{CO_2}=\dfrac{V}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,15\end{matrix}\right.\) ( mol )
\(\Rightarrow\left\{{}\begin{matrix}m_{CH_4}=1,6\left(g\right)\\m_{C_2H_6}=4,5\left(g\right)\end{matrix}\right.\)
=> mhh = 6,1 ( g )
=> %mCH4 = ~ 26,22%
=> %mC2H6 = ~73,78%
Ta có : \(\%V_{CH4}=\dfrac{V}{Vhh}=40\%\)
=> %VC2H6 = 100 - %VCH4 = 60% .
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_6+5O_2\underrightarrow{t^o}4CO_2+6H_2O\)
Giả sử: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_6}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow x+y=\dfrac{5,6}{22,4}=0,25\left(1\right)\)
Ta có: \(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo PT: \(\Sigma n_{CO_2}=n_{CH_4}+2n_{C_2H_6}\)
\(\Rightarrow x+2y=0,4\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,25}.100\%=40\%\\\%V_{C_2H_6}=60\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{0,1.16+0,15.30}.100\%\approx26,2\%\\\%m_{C_2H_6}\approx73,8\%\end{matrix}\right.\)
Bạn tham khảo nhé!
\(Đặt:n_{Fe}=a\left(mol\right);n_S=b\left(mol\right)\left(a,b>0\right)\\ 3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ S+O_2\rightarrow\left(t^o\right)SO_2\\ \Rightarrow\left\{{}\begin{matrix}56a+32b=20\\\dfrac{44,8}{3}a+22,4b=6,72\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,1\end{matrix}\right.\\ a,\%m_{Fe}=\dfrac{0,3.56}{20}.100\%=84\%\\ \%m_S=100\%-84\%=16\%\\ b,m_{sp}=m_{hhFe,S}+m_{O_2}=20+0,3.32=29,6\left(g\right)\)
a) \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\) (mol)
Gọi x,y lần lượt là số mol của Fe và S.(x,y>0)
Theo bài ra, ta có: 56x+32y=20 (I)
PTHH: \(3Fe\) + \(2O_2\)\(\underrightarrow{t^o}\)\(Fe_3O_4\).
Theo pt: x\(\rightarrow\) \(\dfrac{2}{3}x\) \(\dfrac{1}{3}x\) (mol) (1)
PTHH: \(S+O_2\) \(\underrightarrow{t^o}\) \(SO_2\).
Theo pt: y \(\rightarrow\) y y (mol) (2)
Từ (1) và (2) \(\Rightarrow\) \(\sum n_{O_2}=\dfrac{2}{3}x+y=0,3\) (mol) (II)
Giải hệ phương trình (I) và (II) ta được \(\left\{{}\begin{matrix}x=0,3\\y=0,1\end{matrix}\right.\)
\(\Rightarrow\) \(m_{Fe}=0,3.56=16,8\left(g\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{16,8}{20}.100\%=84\%\)
\(\Rightarrow\%m_S=100\%-84\%=16\%\)
b) \(m_{Fe_3O_4}=0,1.\left(3.56+4.16\right)=23,2\left(g\right)\)
\(m_{SO_2}=0,1.\left(32+2.16\right)=6,4\left(g\right)\)