Có 400 ml dung dịch Á chứa đồng thời H2SO4 0,0375M và HCl 0,0125M tính nông đọ MOL ion H+ có trong A
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

15 tháng 3 2018
Đáp án B
nOH- = 0,1.2.0,1 + 0,1.0,1 = 0,03
nH+ = 0,4.2.0,0375 + 0,4.0,0125 = 0,035
⇒ Trong X có H+ dư
⇒ nH+/X =0,035 – 0,03 = 0,005; VX = 100 + 400 = 500ml
⇒ [H+] = 0,01 ⇒ pH = 2.

14 tháng 10 2017
Đáp án B
nOH-= 0,03 mol; nBa2+ = 0,01 mol
nH+ = 0,035 mol; nSO4(2-) = 0,015 mol
H+ + OH- → H2O
0,035 0,03
nH+ dư = 5.10-3 mol; [H+] dư = 5.10-3/0,5 = 0,01 suy ra pH = 2

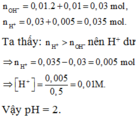


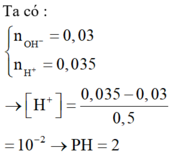
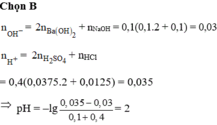
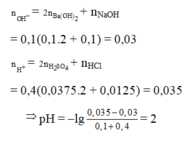
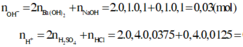
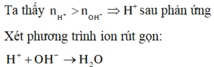
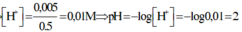
Ta có: \(\left\{{}\begin{matrix}n_{H_2SO_4}=0,4.0,0375=0,015\left(mol\right)\\n_{HCl}=0,4.0,0125=0,005\left(mol\right)\end{matrix}\right.\)
`=>` \(n_{H^+}=0,015.2+0,005=0,035\left(mol\right)\)
`=>` \(\left[H^+\right]=\dfrac{0,035}{0,4}=0,0875M\)
\(n_{H_2SO_4}=V\cdot CM_{H_2SO_4}=0.4\cdot0.0375=0.015mol\\ n_{HCl}=V\cdot CM_{HCl}=0.4\cdot0.0125=0.005mol\\ \left[H^+\right]=\dfrac{n_H}{V}=\dfrac{\left(0.015\cdot2\right)+0.005}{0.4}=0.0875\left(\dfrac{mol}{l}\right)\)