Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nOH- = 0,1.2.0,1 + 0,1.0,1 = 0,03
nH+ = 0,4.2.0,0375 + 0,4.0,0125 = 0,035
⇒ Trong X có H+ dư
⇒ nH+/X =0,035 – 0,03 = 0,005; VX = 100 + 400 = 500ml
⇒ [H+] = 0,01 ⇒ pH = 2.

Đáp án B
nOH-= 0,03 mol; nBa2+ = 0,01 mol
nH+ = 0,035 mol; nSO4(2-) = 0,015 mol
H+ + OH- → H2O
0,035 0,03
nH+ dư = 5.10-3 mol; [H+] dư = 5.10-3/0,5 = 0,01 suy ra pH = 2

a) trong 100 ml dung dịch HCl và H2SO4
CM[H+]=[Cl-]=0,02 M
[SO4 2-]=0,01M
[H+] =2.0,01=0,02 M
trong 100ml dung dịch KOH và Ba(OH)2
[K+]=[OH-]=0,01M
[Ba2+]=0,01M
[OH-]=0,02M
b)n(H+)=0,02+0,02=0,04mol
n(OH-)=0,01+0,02=0,03mol
khi trộn : H+ + OH- =>H2O
0,03<--0,03
=> nH+ dư=0,01mol
=> [H+]=0,05M
=> pH=-lg(0,05)=1,3

ban đầu tính nH+ và nOH-
và trộn H+ và OH- ta được PT điện li của nước
rồi bạn chạy mol
=> số mol chất dư
=> tính CM ion dư
=> pH

bài này có khác bài mk vừa giải giúp bạn đâu cứ viết pt phân li suy ra mol từng ion ,thể tích sau phản ứng = tổng thể tích dung dịch bạn đầu ý b thì tính mol H+ và OH- ra ion nào dư tính n chất dư xong tính nồng độ xong suy ra ph thôi

a) Nồng độ của HCL :[H+] = 0,05 (M)
Nồng độ của H2SO4 :[H+] = 0,1 ( M)
Nồng độ của Ba(OH)2 : [OH-] = 0,2 (M)
b) ph= 13,4 ![]()

a) \(m_{ddAl_2\left(SO_4\right)_3}=200\cdot1,2=240\left(g\right)\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=\dfrac{240\cdot28,5}{100}=68,4\left(g\right)\)
\(\Rightarrow n_{Al_2\left(SO_4\right)_3}=0,2mol\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al^{3+}}=2n_{Al_2\left(SO_4\right)_3}=0,4mol\\n_{SO^{2-}_4}=0,6mol\end{matrix}\right.\)
b) \(n_{HCl}=0,1\cdot3=0,3mol\) \(\Rightarrow n_{Cl^-}=0,3mol\)
\(n_{HNO_3}=0,1\cdot1=0,1mol\) \(\Rightarrow n_{NO^-_3}=0,1mol\)
\(\Sigma n_{H^+}=n_{HCl}+n_{HNO_3}=0,3+0,1=0,4mol\)

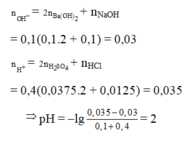
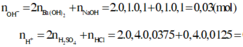
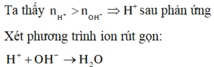
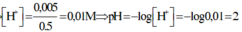
Ta có: \(\left\{{}\begin{matrix}n_{H_2SO_4}=0,4.0,0375=0,015\left(mol\right)\\n_{HCl}=0,4.0,0125=0,005\left(mol\right)\end{matrix}\right.\)
`=>` \(n_{H^+}=0,015.2+0,005=0,035\left(mol\right)\)
`=>` \(\left[H^+\right]=\dfrac{0,035}{0,4}=0,0875M\)
\(n_{H_2SO_4}=V\cdot CM_{H_2SO_4}=0.4\cdot0.0375=0.015mol\\ n_{HCl}=V\cdot CM_{HCl}=0.4\cdot0.0125=0.005mol\\ \left[H^+\right]=\dfrac{n_H}{V}=\dfrac{\left(0.015\cdot2\right)+0.005}{0.4}=0.0875\left(\dfrac{mol}{l}\right)\)